
分析 (1)依据方程式结合化学平衡常数为生成物浓度幂之积与反应物浓度幂之积比值解答;
(2)根据溶液颜色与反应物(或生成物)浓度的关系(即比色分析)来分析选用的仪器;
(3)Na2S2O3与硫酸发生氧化还原反应生成S、二氧化硫、硫酸钠和水;
解答 解:(1)氯气与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,则化学平衡常数K=$\frac{c(H{\;}^{+})c(Cl{\;}^{-})c(HClO)}{c(Cl{\;}_{2})}$,故答案为:K=$\frac{c(H{\;}^{+})c(Cl{\;}^{-})c(HClO)}{c(Cl{\;}_{2})}$;
(2)由利用溶液颜色与反应物(或生成物)浓度的关系,可以确定该化学反应的速率,给出的仪器中只有分光光度计可进行比色分析,
故答案为:分光光度计;
(3)Na2S2O3与硫酸发生氧化还原反应生成S、二氧化硫、硫酸钠和水,离子反应为S2O32-+2H+=SO2↑+S↓+H2O,故答案为:S2O32-+2H+=SO2↑+S↓+H2O;
点评 本题考查平衡常数的表达式以及离子反应方程式的书写等,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL盐酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 测得某温度下硝酸钾的溶解度是36.5g | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷分子所含质子数为10NA | |
| B. | 1mol乙烷分子含有8NA个共价键 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

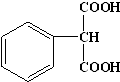 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:5 | C. | 3:4 | D. | 4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合条件的X元素有2种 | |
| B. | Y的最高价氧化物的水化物不可能是强酸 | |
| C. | Y的氢化物中可能存在离子键 | |
| D. | Y的单质在常温下可能是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com