
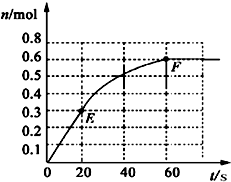
 373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:
373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应: PCl3(g)+Cl2 (g).其中物质PCl3的物质的量变化如右图所示.
PCl3(g)+Cl2 (g).其中物质PCl3的物质的量变化如右图所示.| △c |
| △t |
| c(PCl3)c(Cl2) |
| c(PCl5) |
| c(PCl3)c(Cl2) |
| c(PCl5) |
| ||
| △t |
| ||
| 20s |
 PCl3(g)+Cl2 (g),
PCl3(g)+Cl2 (g),| c(PCl3)c(Cl2) |
| c(PCl5) |
| 0.6×0.6 |
| 0.4 |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
 (2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.
(2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.| c2(B) |
| c(A) |
| c2(B) |
| c(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
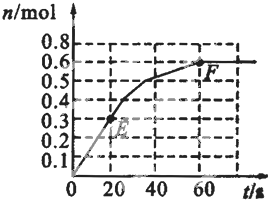 373K时,某1L密闭容器中发生如下可逆反应:A (g)?2B (g).其中物质B的物质的量变化如图所示
373K时,某1L密闭容器中发生如下可逆反应:A (g)?2B (g).其中物质B的物质的量变化如图所示查看答案和解析>>
科目:高中化学 来源:2010—2011学年湖北省黄冈中学高二上学期期末考试化学试卷 题型:填空题
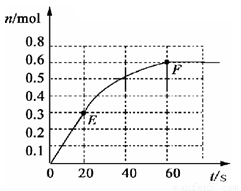
(12分)373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应: 2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
(1)前 20 s内NH3(g)的平均反应速率为 
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率 (填“增大”或“减小”,下同)。NH3的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂  d.再充入N2
d.再充入N2
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省深圳市高三上学期第三次测试(理综)化学部分 题型:填空题
373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应: 其中物质PCl3的物质的量变化如右图所示。
其中物质PCl3的物质的量变化如右图所示。
(1)前 20 s内 PCl5(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的 PCl5,与原平衡比较,新平衡时 PCl5的转化率 (填“增大”或“减小”,下同)。PCl5的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为 PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中 Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入 PCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com