
现有标准状况下氨气521L,将其溶于1L水制得密度为0.9g/cm3的氨水,计算该氨水的物质的量浓度。(计算结果保留小数点后一位)
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
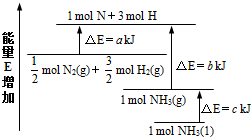 Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V(臭氧空气) | V(烟气) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4•2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O→ 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO29.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市浦东新区高三下学期4月质量抽测化学试卷(解析版) 题型:填空题
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4•2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2
9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若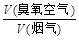 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:0103 期中题 题型:填空题
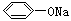 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3  > HCO3-
> HCO3- 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com