
下列说法正确的是
A.按系统命名法,有机物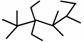 的命名为2,2,4,4 –四甲基-3,3,5-三乙基己烷
的命名为2,2,4,4 –四甲基-3,3,5-三乙基己烷
B.有机物 能与糠醛(
能与糠醛(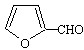 )发生缩聚反应
)发生缩聚反应
C.化合物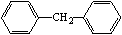 是苯的同系物,且碳原子在同一平面上
是苯的同系物,且碳原子在同一平面上
D.1mol达菲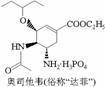 最多能与4molNaOH反应
最多能与4molNaOH反应
科目:高中化学 来源: 题型:
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2+ + b Br- + c Cl2 == d Fe3+ + e Br2 + f Cl- 下列选项中的数字与离子方程式中的
a、b、c、d、e、f一一对应,其中不符合反应实际的是 ( )
A. 2 4 3 2 2 6 B. 0 2 1 0 1 2
C. 2 0 1 2 0 2 D. 2 2 2 2 1 4
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH + 3H+ + NO3—= Cu2++ NO↑+ 2H2O
D.CuH在氯气中燃烧:CuH + Cl2= CuCl + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中溶液的体积变化)试回答下列问题:
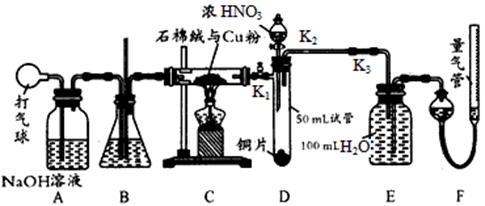
(1)在铜和浓硝酸反应前,挤压打气球,经A、B、C三个装置后,进入装置D中的气体是________(填化学式),通入该气体的目的是________________;进行此步操作时应关闭____(填“K1”“K2”或“K3”,下同),打开____________________。
(2)若装置C的硬质玻璃管中出现堵塞,则装置B中可能出现的现象是________________。
(3)关闭K1、K2,打开K3,由分液漏斗向装置D的试管中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向装置D的试管中加入CCl4至满。则装置D的试管中一定发生的离子反应方程式为________________________。
(4)从装置E所得溶液中取出25. 00 mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL ,则装置E中所得硝酸的物质的量浓度为__________。
(5)实验前量气管的液面读数为368.50 mL,实验后量气管的液面读数为224.00 mL。则上述铜和一定量的浓硝酸反应中________(填“有”或“无”)NO生成,写出推导过程。
_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I—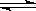 2Fe2++I2
2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5 mL 0.1 mol·L—1 KI溶液,滴加0.1 mol·L—1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2 mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象。
已知:v(正)=k·cm(I—)·cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是1 。加入四氯化碳的作用是 。
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低。为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2 mL | 3 mL | 4 mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
分析实验记录,甲认为导致Fe3+浓度过低的原因是 ;乙同学结合平衡移动的知识,认为还有一个原因是 。
(3)该反应的平衡常数表达式为 。
(4)已知改变I—、Fe3+的浓度,正反应速率对应数值如下表所示:
| c(I—)/mol·L—1 | c(Fe3+)/mol·L—1 | v/mol·L—1·s—1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
分析表中数据,I—浓度对反应速率的影响2 Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”),理由是(写出计算过程)
。
(5)现将反应2Fe3++2I—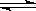 2Fe2++I2设计成下图所示的原电池
2Fe2++I2设计成下图所示的原电池

①能说明反应达到平衡的标志是 (填序号)。
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时 (填“甲"或“乙”)中石墨电极为负极,对应的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作。下列图示对应的操作不规范的是
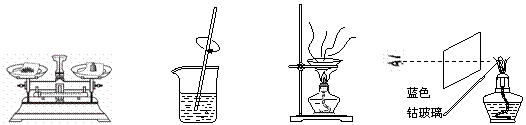

A.称量 B.溶解 C.蒸发 D.焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是 ( )。
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则反应后的溶液中含有的大量阳离子是
A.Cu2+ 和Fe2+ B.H+ 和Cu2+ C. Fe3+ 和Fe2+ D. Fe2+ 和Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com