
| A、氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键 |
| B、原子序数:W>Y>Z>X |
| C、离子的还原性:X>W |
| D、原子半径:Y>Z>X |
| 17+9 |
| 2 |
| 17+9 |
| 2 |


科目:高中化学 来源: 题型:
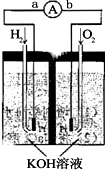 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SiO32-、S2- |
| B、Na+、K+、OH-、SO32- |
| C、Na+、Cl-、H+、ClO- |
| D、Na+、H+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3含有0.5NA SO3分子 |
| B、7.8g Na2O2与足量CO2反应,转移的电子数为0.1NA |
| C、1mol C5H12中含有的共价键数为17NA |
| D、1L 0.1mol?L-1的Na2S溶液中含有0.1NA S2-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:Al+2OH-═AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、钠和冷水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Ⅰ属于芳香烃 |
| B、被Cl2熏蒸过的商标将失去防伪能力 |
| C、Ⅰ和Ⅱ互为同分异构体 |
| D、若R1、R2、R3都是甲基,Ⅱ的分子是C26H24O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、1:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(NH3) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com