
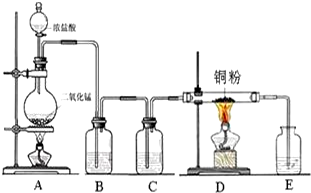
 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:分析 (1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大;
(3)铜在氯气中燃烧生成氯化铜,产生棕黄色的烟;
(4)氯气有毒,用氢氧化钠吸收,反应生成氯化钠、次氯酸钠和水;
(5)只有浓盐酸才与二氧化锰反应,稀盐酸不反应.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水.
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢,氯化氢极易溶于水,氯气的溶解度较小,所以可用饱和食盐水(或水)除去氯气气体中的氯化氢,
故答案为:除去Cl2中的HCl;
(3)铜在氯气中燃烧生成氯化铜,产生棕黄色的烟;
故答案为:产生棕黄色的烟;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)反应过程中浓盐酸部分挥发,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;若实验中用12mol•L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,原因是HCl挥发,浓盐酸变稀不再反应;欲使反应生成Cl2的物质的量最大程度的接近0.03mol,反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
故答案为:HCl挥发,同时不断消耗,而使浓盐酸变稀不再反应;慢慢滴加浓盐酸,缓缓加热;
点评 本题考查了氯气的制备和性质的检验,熟悉氯气制备原理及反应装置特点即可解答,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
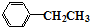 $\stackrel{KMnO_{4}溶液}{→}$
$\stackrel{KMnO_{4}溶液}{→}$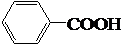
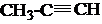 +Br2→CH3-CBr=CHBr
+Br2→CH3-CBr=CHBr $→_{Cl_{2}}^{光照}$
$→_{Cl_{2}}^{光照}$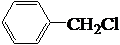 (一卤代物)
(一卤代物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
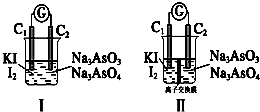
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Fe3+、K+、Cl?、SO42? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
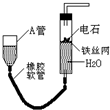 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管外壁发热 | B. | 溶液最后变为蓝色 | ||
| C. | 溶液先变蓝最后褪色 | D. | 有气泡冒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com