
 金属及其化合物在生活、科研、生产中有着重要的作用.
金属及其化合物在生活、科研、生产中有着重要的作用.| 放电 |
| 充电 |
| c(Ca2+) |
| c(Mn2+) |
| 放电 |
| 充电 |
| ||
| ||
| ||
| ||
| c(Ca2+) |
| c(Mn2+) |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
 如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )| A、从D口逸出的气体是H2 |
| B、从B口加入稀NaOH(增强导电性)的水溶液 |
| C、每生成22.4L Cl2,同时产生2mol NaOH |
| D、从A口加入精制的浓食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
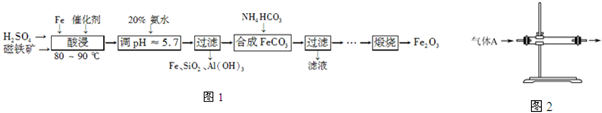
查看答案和解析>>
科目:高中化学 来源: 题型:
 磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 用重结晶方法提纯含NaCl杂质的KNO3 |
| B | 烧杯、玻璃棒、胶头滴管 | 用稀硝酸除去氯化铁中的少量氯化亚铁 |
| C | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用氯水和CCl4除去KCl溶液中的少量KI |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用浓盐酸配制500mL 0.1mol/L的溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下可用铝制容器贮藏运输浓硫酸 |
| B、石英容器可盛放任何酸 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、在海轮外壳上装若干铜块可减缓钢铁腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com