
分析 氧化还原反应中,所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,
水中氢元素为+1价,降价时水表现为氧化性,水中氧元素化合价为-2价,升价时水表现还原性,据此分析解答.
解答 解:(1)钠与水反应中,水中的氢元素化合价降低,氧元素化合价不变,水只作氧化剂,方程式:2Na+2H2O=2NaOH+H2↑;
故答案为;2Na+2H2O=2NaOH+H2↑;
(2)水与氟气反应中,水中氢元素化合价不变,氧元素化合价升高,水只作还原剂,方程式:2F2+2H2O=4HF+O2;
故答案为:2F2+2H2O=4HF+O2;
(3)电解水生成氢气和氧气,反应中水中的氢元素化合价降低,氧元素化合价升高,水既做氧化剂又做还原剂,方程式:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(4)过氧化钠与水反应生成氢氧化钠和氧气,反应中水中的氢元素、氧元素化合价都不变,水既不是氧化剂又不是还原剂,方程式:2Na2O2+2H2O=4NaOH+O2↑;
故答案为;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查了化学方程式的书写,明确氧化还原反应中氧化剂、还原剂概念是解题关键,注意水在反应中氢、氧元素化合价变化,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、S2-、Cl- | B. | H+、Na+、SO42-、NO3- | ||
| C. | K+、Ba2+、OH、SO32- | D. | Na+、K+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:3 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
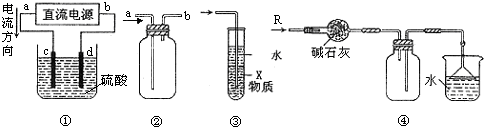
| A. | 装置①中,c、d分别为石墨电极,则c极得到O2、d极得到H2 | |
| B. | 装置②可用于收集NO气体 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氯化氢,并防止倒吸 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 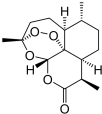 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 一溴代二甲苯 | 234℃ | 20℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
| A. | 邻二甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
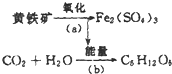 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com