
【题目】由W、X、Y、Z四种短周期元素组成化合物如图。其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍,W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是
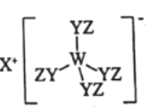
A.原子半径:W>X>Y>Z
B.常温常压下熔点:W2Y3>X2Y>Z2Y
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
【答案】A
【解析】
W、X、Y、Z四种短周期元素,W、X、Y三种简单离子的核外电子排布相同,根据图示化合物的结构简式可知,X为Na元素;Y核外最外层电子数是W核外最外层电子数的二倍,W、Y、Z分别位于三个不同周期,则Z为H元素;Y能够形成2个共价键,则Y最外层含有6个电子,结合“W、X、Y三种简单离子的核外电子排布相同”可知,Y为O;根据“Y核外最外层电子数是W核外最外层电子数的二倍”可知,W最外层含有3个电子,为Al元素,据此解答。
根据分析可知,W为Al,X为Na,Y为O,Z为H元素。
A.同一周期元素从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径大小为:X>W>Y>Z,A错误;
B.Na2O、Al2O3为离子晶体,钠离子半径比镁离子大,钠离子带电荷较少,氧化钠的熔点比Al2O3低;H2O为分子晶体,其熔点较低,则常温常压下熔点:Al2O3>Na2O>H2O,故B正确;
C.Na与O形成的Na2O2、O与H形成的H2O2都是强氧化剂,具有漂白性,C正确;
D.Al与Na的最高价氧化物的水化物分别为Al(OH)3、NaOH,二者反应生成NaAlO2和水,D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
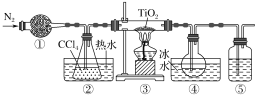
A.①、⑤分别盛装碱石灰、NaOH溶液
B.②中热水的作用是使CCl4汽化,④中冰水的作用是使TiCl4冷凝
C.③中反应结束后,先停止通N2,再停止加热
D.分离④中的液态混合物,采用的操作是分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部份反应条件和产物略去)。
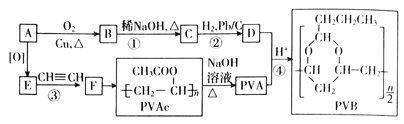
已知:I.A为饱和一元醇,其中氧的质量分数约为34.8%;
II.![]()
![]() ;
;
III.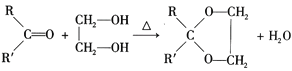 (R、R’可表示烃基或氢原子)
(R、R’可表示烃基或氢原子)
请回答:
(1)C中官能团的名称为_____________,写出C的反式异构体的结构简式:_______________,该分子中最多有______________个原子共面
(2)D与苯甲醛反应的化学方程式为_________________________________________________。
(3)③的反应类型是_________________________
(4)写出两种与F具有相同官能团的同分异构体的结构简式_____________________________。
(5)参照上述信息,设计合成路线,以溴乙烷为原料(其他无机试剂任选)合成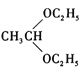 ,_____________
,_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
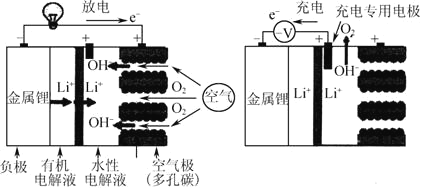
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
查看答案和解析>>
科目:高中化学 来源: 题型:
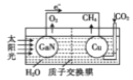
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用取得了突破性的进展。一种镍催化法生产GaN的工艺如图:

(1)“热转化”时Ga转化为GaN的化学方程式是_____。
(2)“酸浸”的目的是_____,“操作Ⅰ”中包含的操作是_____。
某学校化学兴趣小组在实验室利用图装置模拟制备氮化镓:

(3)仪器X中的试剂是_____,仪器Y的名称是_____,装置G的作用是_____。
(4)加热前需先通入一段时间的H2,原因是_____。
(5)取某GaN样品m克溶于足量热NaOH溶液,发生反应 GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
(6)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,成功地实现了用CO2和H2O合成CH4,请写出铜极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。

(1)田老师利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
Ⅰ.分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
Ⅱ.用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅲ.由计算机绘制的滴定曲线如图一:
①A是_____;
②两曲线图中V1_____V2 (填“>”、“=”或“<”),A点和B点,水的电离程度相比_________(填“A大”、“B大”、“一样大”或“无法判断”)。
(2)程老师利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:用_____(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____(填“是”、“否”或“不能确定”),向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二)。
①图中b点时,![]() _______mol/L
_______mol/L
②若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为_____ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
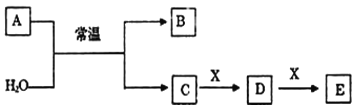
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为___(填代号)。
A.盐酸 B.BaCl2溶液 C.Ca(OH)2溶液
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com