
分析 11.1g氯化钙和13.6g氯化锌的混合物溶于水,加入足量的硝酸银,生成沉淀是AgCl沉淀,是溶液中的氯离子和银离子之间的反应,Ag++Cl-=AgCl↓,氯化银的物质的量和氯离子的物质的量相等,根据元素守恒来计算即可.
解答 解:11.1g氯化钙中氯离子的物质的量n=$\frac{11.1g}{111g/mol}$=0.1mol,13.6g氯化锌中含有氯离子的物质的量n=$\frac{13.6g}{136g/mol}$=0.1mol,所以n(Cl-)=0.2mol,混合液加入足量的硝酸银,生成沉淀是AgCl沉淀:Ag++Cl-=AgCl↓,氯化银的物质的量和氯离子的物质的量相等,所以n(AgCl)=0.2mol,质量是0.2mol×143.5g/mol=28.7g.
答:生成沉淀的物质的量是0.2mol,质量是28.7.
点评 本题考查学生混合物的有关计算,注意物质间反应的实质以及反应的有关计算是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ①③⑥⑦ | C. | ③④⑤⑦ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子序数为34 | B. | 最高价氧化物的化学式为SeO3 | ||
| C. | 硒是金属元素 | D. | 气态氢化物化学式为H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和 HCl 加成 | |
| B. | 乙烯和氯气加成 | |
| C. | 乙烷和 Cl2按 1:2 的体积比在光照条件下反应 | |
| D. | 乙烯先与 HCl 加成,再与等物质的量的氯气在光照条件下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
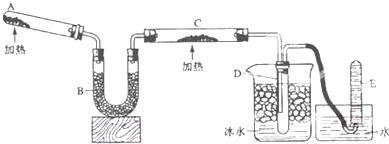
 如图所示装置,回答下列问题:
如图所示装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sn 2+、Fe 2+、Ce 3+ | B. | Sn 2+、Ce 3+、Fe 2+ | ||
| C. | Ce 3+、Fe 2+、Sn 2+ | D. | Fe 2+、Sn 2+、Ce 3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
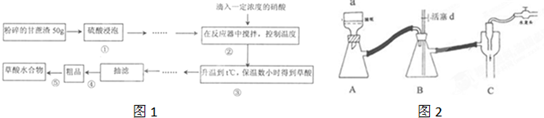
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com