
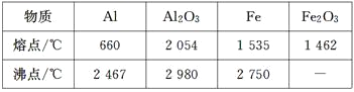
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为__________________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
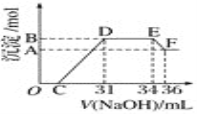
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
【答案】合理 NaOH溶液 2Al+2OH-+2H2O=2AlO2—+3H2↑ B H++OH-=H2O NH4++OH-=NH3·H2O Al3+、Fe3+、H+ NH4+ 0.008 0.032 7
【解析】
Ⅰ.(1)由表中数据比较可知,铝的熔点比铁低,该反应放出的热量使铁熔化,此时液态的铁和铝熔合形成铁铝合金,因此此说法合理;(2)利用金属Al与强碱液反应放出氢气的性质即可验证,而铁不与NaOH发生反应,因此验证合金中含铝单质,需要加入NaOH溶液,其离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)A、Fe、Al与浓硫酸发生钝化反应,阻碍反应的进行,不能用浓硫酸溶解,故A错误;B、Fe和Al属于活泼金属,都能与稀硫酸发生反应,能用稀硫酸溶解,故B正确;C、Fe、Al与稀硝酸反应,但生成有毒的NO,不能用稀硝酸溶解,故C错误;D、Al能与NaOH反应,但Fe不能与NaOH反应,因此不能用NaOH溶解,故D错误;Ⅱ.(1)OC段没有沉淀产生,说明硝酸过量,此阶段发生离子反应方程式为H++OH-=H2O;由图像可知硝酸过量,OC段发生酸碱中和反应,CD段为Fe(OH)3、Al(OH)3沉淀的生成,DE段消耗了NaOH,由此证明硝酸和金属反应的还原产物为较低价态的NH![]() ,DE段发生离子反应方程式为NH4++OH-=NH3·H2O;先产生沉淀,后生成NH3·H2O,说明Al3+、Fe3+、H+结合OH-能力强于NH4+;(3)EF段为Al(OH)3与NaOH反应,其离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,只剩下Fe(OH)3沉淀。B与A的差值为Al(OH)3,则氢氧化铝的物质的量为4mol·L-1×(36-34)×10-3L=0.008mol;(4)参加反应的n(Al)=0.008 mol,因为1 mol的Al3+、Fe3+均与3 mol的NaOH反应,由电子守恒可知Fe和Al化合价升高的总数等于HNO3生成NH
,DE段发生离子反应方程式为NH4++OH-=NH3·H2O;先产生沉淀,后生成NH3·H2O,说明Al3+、Fe3+、H+结合OH-能力强于NH4+;(3)EF段为Al(OH)3与NaOH反应,其离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,只剩下Fe(OH)3沉淀。B与A的差值为Al(OH)3,则氢氧化铝的物质的量为4mol·L-1×(36-34)×10-3L=0.008mol;(4)参加反应的n(Al)=0.008 mol,因为1 mol的Al3+、Fe3+均与3 mol的NaOH反应,由电子守恒可知Fe和Al化合价升高的总数等于HNO3生成NH![]() 降低的总数,即3n(Fe)+3n(Al)=n(NH4+)×8=4 mol·L-1×(34-31)×10-3L×8,解得n(Fe)+n(Al)=0.032 mol,n(Fe)=0.024 mol,两种沉淀的物质的量为0.032 mol,生成两种沉淀共消耗n(NaOH)=0.032 mol×3=0.096 mol,所以C点体积为31 mL-0.096/4×103mL=7 mL。
降低的总数,即3n(Fe)+3n(Al)=n(NH4+)×8=4 mol·L-1×(34-31)×10-3L×8,解得n(Fe)+n(Al)=0.032 mol,n(Fe)=0.024 mol,两种沉淀的物质的量为0.032 mol,生成两种沉淀共消耗n(NaOH)=0.032 mol×3=0.096 mol,所以C点体积为31 mL-0.096/4×103mL=7 mL。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
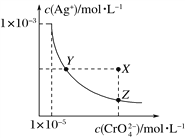
A. t ℃时,Ag2CrO4的Ksp为1×10-8;
B. t ℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀;
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等;
D. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为Z点;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
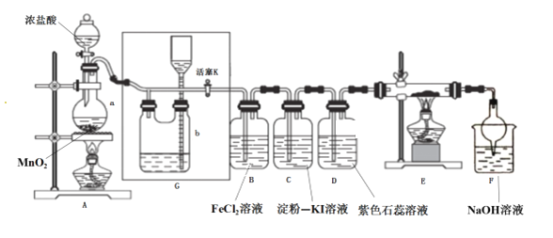
(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(![]() )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
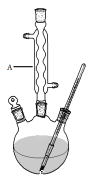
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 ,加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(2)制备水杨酸甲酯时,最合适的加热方法是 。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是 。
(4)反应结束后,分离出甲醇采用的方法是 。
(5)实验中加入无水硫酸镁的作用是 。
本实验的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,根据如图所示的实验装置,回答下列问题:
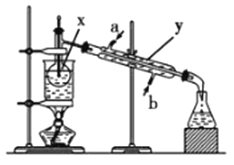
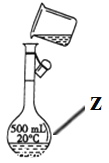
(1)写出下列仪器的名称:x_________;y_____________;z_____________。
(2)仪器y的进水口为_____________(填“a”或“b”)。
(3)请分别指出图中的一处错误_____________________,_________________。
(4)在配置1.0mol/L盐酸溶液时,下列操作会导致所配溶液浓度偏大的是___________(填写字母,下同);浓度不变的是_______。
A.用量筒量取浓盐酸时,俯视量筒刻度线
B.容量瓶未干燥即用来配置溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.未进行洗涤操作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com