
图表示Mg、Al、Fe、Cu四种金属分别与足量Cl2反应时, 金属质量(纵坐标) 与Cl2质量(横坐标)间的关系. 其中代表Mg与Cl2反应的是
[ ]

科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
 R(OH)3
R(OH)3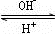 [R(OH)4]-
[R(OH)4]-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:填空题
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有??????? (填序号)

Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4??
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al???????????????
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)?
? 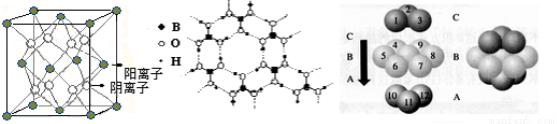
图Ⅰ????????????????????????? 图Ⅱ???????????????????? 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为???????????? ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为?????????????? ;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为?????????????????? (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为?????????????????
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_??? ____cm(用代数式表示)

查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期12月月考化学试卷(解析版) 题型:填空题
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号)

A:σ键 B:π键 C:氢键 D:配位键 E:分子间作用力 F:金属键 G:离子键
(2) 下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
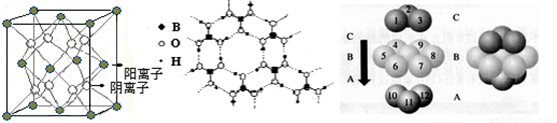
图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
② H3BO3晶体中B原子杂化方式______ ; CNO-的形状为____________;
③ 三种晶体中熔点高低的顺序为 (填空化学式),
H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如右图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)
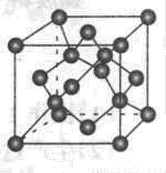
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高新区高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com