

 2Fe3O2(s)+CO2(g) ��H=��47kJ/mol
2Fe3O2(s)+CO2(g) ��H=��47kJ/mol 2Fe(s)+3CO2(g) ��H=��25kJ/mol
2Fe(s)+3CO2(g) ��H=��25kJ/mol 3FeO(s)+CO2(g) ��H=+19kJ/mol
3FeO(s)+CO2(g) ��H=+19kJ/mol Fe��s��+CO2��g���ġ�H= ����֪1092��÷�Ӧ��ƽ�ⳣ��Ϊ0.357����1200��ʱ�÷�Ӧ��ƽ�ⳣ�� 0.357���>����=����<��������1L���ܱ������У�Ͷ��7.2gFeO��0.1molCO2���ȵ�1092�沢���ָ��¶ȣ���Ӧ��ƽ���������CO������ռ���������Ϊ ��
Fe��s��+CO2��g���ġ�H= ����֪1092��÷�Ӧ��ƽ�ⳣ��Ϊ0.357����1200��ʱ�÷�Ӧ��ƽ�ⳣ�� 0.357���>����=����<��������1L���ܱ������У�Ͷ��7.2gFeO��0.1molCO2���ȵ�1092�沢���ָ��¶ȣ���Ӧ��ƽ���������CO������ռ���������Ϊ ��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��̿ȼ������һ����̼ | B���кͷ�Ӧ |
| C��п����ϡH2SO4��Ӧ��ȡH2 | D��Ba(OH)2��8H2O��NH4Cl��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2O3 = 3O2 | B���ɱ����� | C�����ʯ�����ڻ� | D��HCl��������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Ԫ�ص�����һ���������� |
| B�����������ӱ���ԭһ���õ��������� |
| C�����ۻ�������ֻ�����ۼ� |
| D��1H��2H��3H��Ϊͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������ˮ�� | B���������Ȼ��ⷴӦ�����Ȼ�茶��壻 |
| C��ˮ��������ΪҺ̬��ˮ�� | D��(NH4)2CO3�ֽ����ɶ�����̼��������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ���Ȼ�ѧ����ʽ��2H2(g)+O2(g)��2H2O(g) ��H= +483��6 kJ��mol?1 |
| B��������ȼ����Ϊ241��8 kJ��mol?1 |
| C��1 mol H2O(1)����������1 mol H2O(g)������ |
| D��2 mol H2��1 mol O2�������ܺʹ���2 mol H2O(g)������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
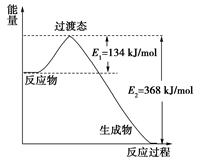
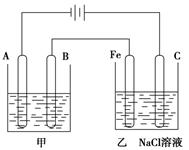
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��Ӧ��Ӧ�ȵIJⶨ����ش��������⣺
��Ӧ��Ӧ�ȵIJⶨ����ش��������⣺
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com