
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
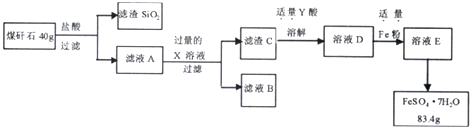
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溶胶都是澄清透明的 | |
| B. | 胶体粒子的直径在1nm~100nm | |
| C. | 可用渗析法(半透膜过滤法)分离液溶胶中的分散质与分散剂 | |
| D. | 可以利用丁达尔效应区分胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
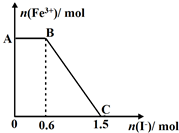 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com