

分析 (1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(2)根据热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1计算;
(3)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,开始为1molSO2和2molO2 的SO2转化率高;
(4)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒计算;
(5)根据平衡移动判断
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动,t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动,该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;
t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高.
解答 解:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1
(2)由由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1;可知,△H2=0.4△H=0.4×(=-196.6KJ•mol-1)=-78.64KJ•mol-1.
故答案为:-78.64KJ•mol-1
(3)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大.
故答案为:大
(4)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol.
若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2+O2+4OH-═2SO42-+2H2O.
故答案为:2mol;2SO2+O2+4OH-═2SO42-+2H2O
(5)a、反应为放热反应,温度升高,平衡逆向移动,n(SO3)减小,n(SO2)增大,n(SO3)/n(SO2)减小,故a错误;
b、恒容条件下,充入氦气,反应混合物浓度不变,平衡不移动,n(SO3)/n(SO2)不变,故b错误;
c、再充入1molSO2(g)和1molO2 (g),等效为Ⅱ压强增大一倍,平衡正向移动,n(SO3)/n(SO2)增大,故c正确;
d、使用催化剂,加快反应,平衡不移动,n(SO3)/n(SO2)不变,故d错误.
故答案为:C
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动.t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动.该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;
t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高.
故答案为:升高温度;t3~t4;
点评 本题考查热化学方程式、化学平衡等,综合性高,题目难度中等,关键在于读图获取信息,培养学生分析问题解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
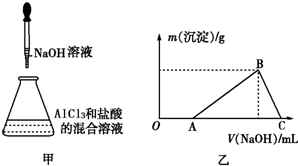 某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
某同学称取一定质量的AlCl3固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液如图甲所示.滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 500 mL1 mol/L MgCl2溶液中含有Cl-数目为0.5NA | |
| B. | 标准状况下,33.6L SO3与48gO2所占的体积相等 | |
| C. | 17 gNH3含有的电子个数为l0NA | |
| D. | 1 mol O2与2 mol SO2一定条件下混合反应,可生成2 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.| 步骤 | 预期现象和结论 |
| 步骤1:取C中少量样品于试管中,滴加足量蒸馏水 至溶解,然后将所得溶液分别置于A、B试管中 | 固体物质全部完全溶解 |
| 步骤:向A试管中滴加适量BaCl溶液 | a. 如果 b. 如果 |
| 步骤: | 有白色沉淀生成,C的部分有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaOH$→_{△}^{CaO}$R═H+Na2CO3
+NaOH$→_{△}^{CaO}$R═H+Na2CO3 .
. .
.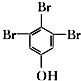 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com