
| A. | 原子半径由小到大排序为:X<Y<Z<W | |
| B. | Z的最高价氧化物既能与某酸反应,又能与某碱反应,属于两性物质 | |
| C. | Y单质在一定条件下可以跟四氧化三铁发生置换反应 | |
| D. | 室温下,0.1 mol•L-1 W的气态氢化物的水溶液中氢离子的浓度为0.2mol•L-1 |
分析 X、Y、W的最高价氧化物的水化物两两之间可以发生复分解反应,则Y为Al元素,说明四种元素一定位于第三周期;Z原子的最外层电子数是次外层电子数的一半,且处于第三周期,则Z为Si元素;X、Y、Z、W原子序数关系为X+W═Y+Z,即:X+W=13+14=27,则X为Na元素,W为S元素,据此进行解答.
解答 解:X、Y、W的最高价氧化物的水化物两两之间可以发生复分解反应,则Y为Al元素,说明四种元素一定位于第三周期;Z原子的最外层电子数是次外层电子数的一半,且处于第三周期,则Z为Si元素;X、Y、Z、W原子序数关系为X+W═Y+Z,即:X+W=13+14=27,则X为Na元素,W为S元素,
A.同周期原子半径依次减小,所以半径顺序为:X>Y>Z>W,故A错误;
B.Z为Si元素,其氧化物为二氧化硅,二氧化硅既能与氢氟酸反应,又能与氢氧化钠溶液反应,但是由于它只与氢氟酸不与其它酸反应,所以不属于两性物质,故B错误;
C.Y为Al元素,Al在高温条件下可以跟四氧化三铁发生置换反应生成铁和氧化铝,故C正确;
D.W为S元素,其气体氢化物为硫化氢,由于硫化氢为弱酸,所以室温下0.1 mol•L-1 硫化氢的水溶液中氢离子的浓度小于0.2mol•L-1,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,涉及元素周期表和周期律、二氧化硅、铝的化学性质等知识,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | 镁和铁 | B. | 钠和铁 | C. | 钠和铝 | D. | 铁和铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、SO42-、K+、Cl- | B. | Na+、NH4+、NO3-、Fe3+ | ||
| C. | K+、CO32-、Cl-、Br- | D. | Ba2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
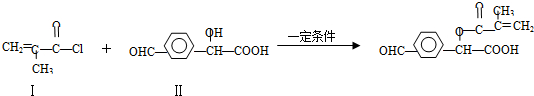
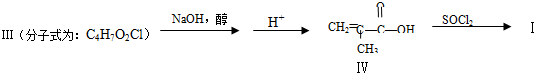
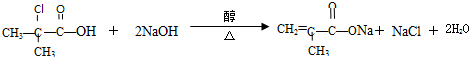 .
.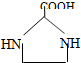 与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为
与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为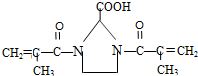 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度范围(℃) | 固体质量(g) |
| 150-210 | 4.41 |
| 290-320 | 2.41 |
| 890-920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| B. | 用硝酸酸化的硝酸银溶液能一次鉴别NaCl,NaBr,KI三种失去标签的溶液 | |
| C. | 某溶液中加入CCl4,CC14层显紫色,证明原溶液中存在I- | |
| D. | 某浅黄色的溴水,加入CC14震荡静置后,上层显橙红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com