
【题目】(1)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体 能分解生成15mLO2和10mLF2(在同温同压下),A的化学式是_____。
(2)VLFe2(SO4)3溶液中含有agSO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中 Fe3+的物质的量的浓度为____。
【答案】O3F2 a/576mol/L
【解析】
(1)相同条件下,气体的体积之比等于其物质的量之比,同一反应中,参加反应的各物质的物质的量之比等于其计量数之比,再结合质量守恒确定A化学式.
(2)根据n=![]() 计算出硫酸根离子的物质的量,从而可计算出0.5L溶液中含有的硫酸根离子,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中铁离子的物质的量,最后根据c=
计算出硫酸根离子的物质的量,从而可计算出0.5L溶液中含有的硫酸根离子,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中铁离子的物质的量,最后根据c=![]() 计算出稀释后溶液中Fe3+的物质的量的浓度.
计算出稀释后溶液中Fe3+的物质的量的浓度.
(1)相同条件下,气体的体积之比等于其物质的量之比,同一反应中,参加反应的各物质的物质的量之比等于其计量数之比,所以参加反应的A、O2、F2的计量数之比=10mL:15mL:10mL=2:3:2,再结合质量守恒定律得A中含有3个O、2个F原子,O电负性小于F元素,所以二者形成的化合物A中O显正化合价、F元素显负化合价,所以A的化学式为O3F2,
故答案为:O3F2;
(2)ag硫酸根离子的物质的量为:![]() ,取出的0.5VL溶液中含有硫酸根离子的物质的量为:
,取出的0.5VL溶液中含有硫酸根离子的物质的量为:![]() mol×0.5V÷VL=a/192mol,
mol×0.5V÷VL=a/192mol,
稀释过程中溶质的物质的量不变,则稀释后溶液中铁离子物质的量为:a/192mol×2/3=a/288mol,
则稀释后溶液中铁离子浓度为:a/288mol÷2VL=a/576mol/L,
故答案为:a/576mol/L。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
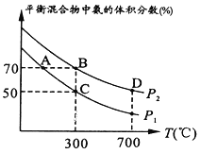
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种重要的清洁能源。
(1)航天员呼吸产生的![]() 利用
利用![]() 反应:
反应:![]() H,再电解水可实现
H,再电解水可实现![]() 的循环利用。
的循环利用。
①热力学中规定,由最稳定单质生成![]() 某物质的焓变称为该物质的标准生成焓(符号:
某物质的焓变称为该物质的标准生成焓(符号:![]() ),最稳定单质的标准生成焓规定为0。已知上述反应式中:
),最稳定单质的标准生成焓规定为0。已知上述反应式中:
![]() ;
;![]() ;
;![]() ;
;
![]() ;则
;则![]() _____
_____![]() 。
。
②![]() 反应必须在高温下才能进行,原因是___________________________。
反应必须在高温下才能进行,原因是___________________________。
③350℃时,向体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() 发生以上反应。
发生以上反应。
测得反应过程中压强随时间的变化如下表所示:
时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强 |
|
|
|
|
|
|
|
350℃时![]() 反应的
反应的![]() ______(
______(![]() 为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
(2)利用乙醇重整制氢是获得氢能的研究热点,其主要反应原理为:
反应Ⅰ: ![]() H1
H1
若同时通入水蒸汽,还会发生如下反应
反应Ⅱ:![]() H2
H2
反应Ⅲ:![]() H3
H3
反应Ⅳ:![]() H4
H4
一定温度下,某恒压密闭容器中充入一定量的![]() 发生反应。
发生反应。
已知:氢气选择性指转化的原料气中,转化成氢气的氢元素质量与转化的氢元素总质量的比值。
①下列有关说法正确的是_______________。
A.当混合气的平均相对分子质量不变时,说明反应达到平衡状态
B.增大乙醇初始浓度,能够提高乙醇的平衡转化率
C.其它条件不变,掺入稀有气体,可提高乙醇平衡转化率
D.其它条件不变,掺入水蒸气,可提高氢气的选择性和氢气的体积分数
②下图为上述条件下n(H2)随反应时间的变化曲线图。若其它初始条件相同,只把容器变为恒容密闭容器,请画出恒容条件下,n(H2)随反应时间的变化曲线图________________。

③乙醇重整制氢过程中,还可能生成固态炭,固态炭的生成会造成催化剂失活,应尽量避免。研究其它条件相同下,反应温度、氧醇比、水醇比与生成固态炭的条件,得到下图:

试根据图象分析,反应温度、氧醇比、水醇比对固态炭生成的影响_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是

A.Janusene的分子式为C30H20
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene既可发生氧化反应,又可发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应N2O4(g)![]() 2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. B、C两点NO2的体积分数相同,所以平衡常数也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
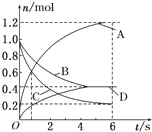
A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B和D的物质的量浓度均为0.4molL﹣1
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )

A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com