
����Ŀ���±���25��ʱ����ĵ���ƽ�ⳣ��������˵����ȷ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.1��10��7 Ka2=5.6��10��11 |
A.���ݱ������ݿ�֪����ͬŨ��CH3COONa��NaClO�Ļ����Һ�У���������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)��c(ClO��)��c(CH3COO��)��c(OH��)��c(H+)
B.���ݱ������ݿ�֪������������Һ��ͨ������CO2�����ӷ���ʽΪ��2ClO��+CO2+H2O=CO32��+2HClO
C.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��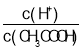 ��С
��С
D.�����£���̼������Һ������70������Һ���е�OH����Ŀ����
���𰸡�D
��������
A. ���ݱ������ݿ�֪����ͬŨ��CH3COONa��NaClO�Ļ����Һ�У�NaClO��ˮ��̶Ƚϴ����������Ũ�ȵĴ�С��ϵ�ǣ�c(Na+)��c(CH3COO��)��c(ClO��)��c(OH��)��c(H+)��A����
B. ���ݱ������ݿ�֪���ԣ�HClO> HCO3��������������Һ��ͨ������CO2�����ӷ���ʽΪ��ClO��+CO2+H2O= HCO3��+HClO��B����
C. ��0.1mol��L-1CH3COOH��Һ�м�������ˮ�����������ƽ��������У���c(CH3COOH)��С�ij̶ȴ���c(H+)����Һ��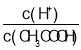 ����C����
����C����
D. �����£���̼������Һ������70�����¶����ߣ�̼���Ƶ�ˮ��ƽ��������У���Һ���е�OH-��Ŀ���࣬D��ȷ��
��ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҷ��ɢ��isoprocard����ˮ��Ҷ���ͷ�ʭ���н�ǿ�Ĵ�ɱ���ã���ЧѸ�٣�����Ч��������ҵ��������������Ӻϳ�Ҷ��ɢ�Ĺ������£�

�����й�˵����ȷ���ǣ�������
A.Ҷ��ɢ�ķ���ʽ��C11H16NO2
B.����������ӷ�����ȡ����Ӧ
C.Ҷ��ɢ��ǿ�ᡢǿ���Ի��������ȶ�����
D.����FeCl3����Ҷ��ɢ���Ƿ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ�����Ʒ��ʵ������������������ˮ��Һ�Ʊ������װ����ͼ��ʾ(���ȡ�����������̶�װ�þ�����ȥ)��

ʵ��������£�
�ٽ�һ�����ĵ���ˮ��Һ��������ƿ�У�
�ڿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ���(65%HNO3��98%H2SO4��������Ϊ2��1.5)��Һ��
�۷�Ӧ3h���ң���ȴ�����˺����ؽᾧ�ò��ᾧ�壻
������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
(1)��������Ƿ�ˮ����ȫ�����õ��Լ�Ϊ________��
(2)ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
(3)װ��C����β�����գ���β����n(NO2)��n(NO)=1��1ʱ��������NaOH��Һ�ܽ�NO��ȫ�����գ�ԭ����_________(�û�ѧ����ʽ��ʾ)��
(4)����NaOH��Һ����β����Ƚϣ����õ���ˮ��Һ����β�������š�ȱ����________��
(5)�����ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ﮣ�LiFePO4�����������Դ�����Ķ������֮һ����ش��������⣺
��1����̬Feԭ�ӵļ۵��ӹ����ʾʽ�������Ų�ͼ��Ϊ____��O2-���������___���˶�״̬��
��2��﮵��Ϻ�ɫ��ɫ��һ��_______���ף�LiFePO4��������VSEPRģ������Ϊ______������ԭ�ӵ��ӻ��������Ϊ____��
��3��һ������£�ͬ�����ʹ�̬ʱ�ܶȱ�Һ̬����ͨ�����ܶȱ�ˮС��ԭ����____________��H2O2������CS2����Ҫ˵�����ɣ�____________________��
��4��Li2O�����Ӿ��壬�侧���ܿ�ͨ����ͼ��Born - Haberѭ������õ�����֪��Li2O������Ϊ____kJ/mol��
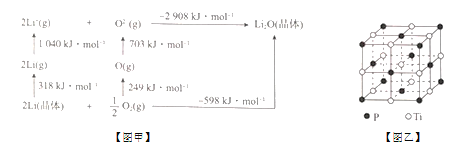
��5�������۵�ߡ�Ӳ�ȴ��侧����ͼ����ʾ��
�����Ѿ�����Tiԭ����Χ���ڽ���Ti��ĿΪ____���辧����Tiԭ�������ڽ���Pԭ��֮��ľ���Ϊr����Tiԭ����������ڽ���Pԭ��֮��ľ���Ϊ_______��
�������Ѿ�����Ti��Pԭ�Ӱ뾶�ֱ�Ϊa pm��b pm�������ھ����н��ܽӴ�����þ�����ԭ�ӵĿռ�������Ϊ_____ ����a��b��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿��ĩ����Ҫ�ɷ�MnO2��������Al2O3��Fe2O3�����ʣ�Ϊԭ����MnSO4��H2O�Ĺ����������£�
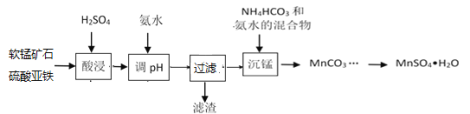
��֪��pH��3.3����Һ������Fe3+��pH��5.0����Һ������Al3+��pH��8��Mn2+��ʼ������
��1�����������������䣬�ڲ�ͬ�¶��¶Ժ����̿�۽���������̽�������ʱ��仯��ͼ�����������¶���ʱ��ֱ�Ϊ________�桢______min��
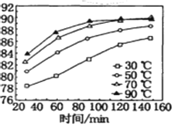
��2���������ʱ���ὫFe2+������Fe3+���������ķ�Ӧ���ӷ���ʽΪ__________��
��3�����ʱҪ�������ᣬ����Ũ�Ȳ��ܹ�����߹�С��������Ũ�ȹ�Сʱ��������к��ɫ�������֣�ԭ����_____________________________��
��4��MnSO4��ˮ�е��ܽ�����¶ȹ�ϵ��ͼ����MnCO3��ýϴ�����MnSO4H2O����ķ����ǣ���MnCO3����_________�������¶�Ϊ_________���Ͻᾧ���õ�MnSO4H2O���壬ϴ�ӡ���ɡ�
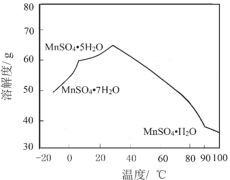
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ���COS������Ϊһ����ʳѬ�������ܷ�ֹijЩ���桢�߳�������Σ�����ں����ܱ������У���CO��H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO��g��+H2S��g�� ![]() COS��g��+H2��g�� K=0.1����ӦǰCO���ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ����
COS��g��+H2��g�� K=0.1����ӦǰCO���ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ����
A.CO��ƽ��ת����Ϊ20%B.�����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�����ȷ�Ӧ
C.��ӦǰH2S���ʵ���Ϊ8molD.ͨ��CO������Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ��Ϊ![]() ������ֱ���μ��뵽
������ֱ���μ��뵽![]() ������һԪ��MOH��ROH��Һ�У�pH��������Һ����ı仯��ͼ��ʾ������˵����ȷ����
������һԪ��MOH��ROH��Һ�У�pH��������Һ����ı仯��ͼ��ʾ������˵����ȷ����![]()
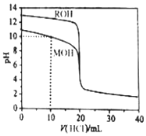
A.![]() ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�
ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�![]()
B.������MOH��ROH��Һ�������Ϻ�������ζ���MOHǡ�÷�Ӧʱ����Һ������Ũ�ȵĹ�ϵ�ǣ�![]()
C.![]() ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�
ʱ����Һ����Ũ�ȵĹ�ϵ�ǣ�![]()
D.![]() ʱ�������ܴ��ڣ�
ʱ�������ܴ��ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4��K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
��ش�
��1�������ϱ��е�ʵ�����ݣ����Եõ��Ľ�����__________________��
��2����С��ͬѧ���ݾ��������n(Mn2+)��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+) ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����

��С��ͬѧ����ļ�����___________________________________________________��
��3����Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�4mLѪҺ������ˮϡ�ͺ������м������������(NH4)2C2O4���壬��Ӧ����CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0-4mol/L��KMnO4��Һ��
�ζ��յ��������_________________________________��
�����в����ᵼ�²ⶨ���ƫ�͵���______��
A����ƿ�ô��������Һ��ϴ
B���ζ������У���ƿҡ����̫���ң���ƿ����Һ�ν���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��յ�ʱ��������
D���ﵽ�ζ��յ�ʱ�����Ӷ���
���㣺ѪҺ�к������ӵ�Ũ��Ϊ______mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��������ӵ�����������˵��������� ( )
A.12g C60���6NA������
B.1mol HNO3����ֽ⣬ת�Ƶ�����4NA
C.46g NO2��46g N2O4���е�ԭ������Ϊ3NA
D.60g SiO2���������Ӧ�������������ͷų�NA���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com