
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1
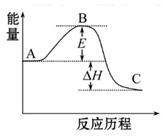
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
科目:高中化学 来源: 题型:
下列实验装置设计正确、且能达到目的的是
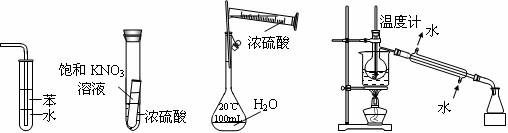
Ⅰ Ⅱ Ⅲ Ⅳ
A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:回收利用碘的CCl4 溶液中的有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同主族元素的说法错误的是( )
A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强
B. 同主族元素随原子序数递增,单质氧化能力逐渐减弱
C. 同主族元素原子最外层电子数都相同
D. 同主族元素的原子半径,随原子序数增大而逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,错误的是( )
A.甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯
B.苯在合适条件下催化加氢可生成环己烷
C.丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷
D. 苯与浓硝酸、浓硫酸共热并保持50℃-60℃反应生成硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
A. c点处正反应速率和逆反应速率相等
B. a点处正反应速率比b点处的大
C. d点(t1时刻)和e点(t2时刻)处n(N2)不同
D. t2时刻,正反应速率大于逆反应速率
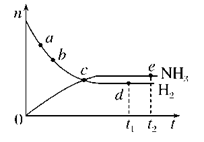
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解、过滤的方法分离KNO3和NaCl
D.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
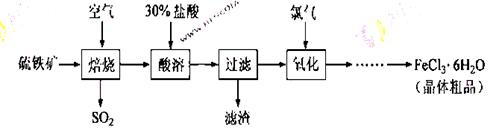
回答下列问题:
(1)在一定条件下,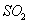 转化为
转化为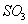 的反应为
的反应为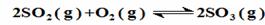 该反应的平衡常数表达式为K= ;过量的
该反应的平衡常数表达式为K= ;过量的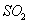 与
与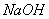 溶液反应的化学方程式为
溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com