
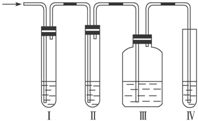
 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)分析 (1)①二氧化硫是否存在可用品红溶液检验.检验乙烯可以用溴水或高锰酸钾酸性溶液;乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色;
乙烯与溴水发生加成反应使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br,乙烯被酸性高锰酸钾氧化使其褪色.二氧化硫与溴水、酸性高锰酸钾发生氧化还原反应,5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4,SO2+Br2+H2O═H2SO4+2HBr;
乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),故乙烯的检验应放在排除SO2的干扰后进行,
②实验室利用乙醇能发生消去反应制乙烯;
③选通过品红溶液褪色检验SO2的存在;
④再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.
⑤最后用高锰酸钾酸性溶液褪色实验检验乙烯;
(2)①乙烯与液溴发生加成反应生成1,2-二溴乙烷;
②检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,据此即可解答.
解答 解:(1)①乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯,
故答案为:A;B;A;D;
②实验室利用乙醇能发生消去反应制乙烯:CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
③二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,故答案为:装置Ⅰ中品红溶液褪色;
④通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,故答案为:检查二氧化硫是否除尽;
⑤最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯,
故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色.
(2)①乙烯与液溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br:
②检验溴乙烷中含有溴元素首先将它转化为溴离子,采用卤代烃的水解方法,即加入氢氧化钠,在水解后生成的溴离子可以和银离子反应,生成淡黄色不溶于硝酸的沉淀溴化银,由此来检验溴乙烷中的溴元素,所以操作为:加入NaOH溶液,加热,溴乙烷在碱性条件下水解生成溴化钠和乙醇,冷却,加入稀HNO3酸化后加入AgNO3溶液,溴离子和银离子反应生成淡黄色不溶于硝酸的溴化银沉淀.
故答案为:D.
点评 本题考查乙烯的化学性质、制备以及常见气体的检验,题目难度中等,注意实验的先后顺序


科目:高中化学 来源: 题型:选择题
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4)(5) | B. | (3)(1)(4)(2)(5) | C. | (5)(1)(3)(2)(4) | D. | (5)(4)(3)(2)(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
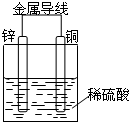
| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
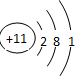
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
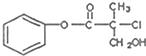
| A. | 该有机物可以在一定条件下与HBr发生反应 | |
| B. | 1mol该有机物最多能与4molH2发生加成反应 | |
| C. | 该有机物在一定条件下可以发生消去反应 | |
| D. | 1mol该有机物一足量的NaOH溶液反应,最多可以消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com