
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |


分析 (1)酯化反应机理为酸脱羟基醇脱氢,据此写出该反应的化学方程式,根据酯化反应中浓硫酸的作用进行解答;
(2)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
(3)分液用于分离两种不互溶的液体,蒸馏用于互溶但沸点相差较大的两种(或两种以上)液体分离;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,据此答题;
(5)产率=$\frac{实际产量}{理论产量}$×100%,根据反应物的物质的量判断过量,根据不足量计算出理论上生成苯甲酸甲酯的物质的量,再计算出其产率.
解答 解:(1)苯甲酸与甲醇在浓硫酸作用下的酯化反应为:苯甲酸脱去羟基,据此脱去羟基中的氢原子,二者反应生成苯甲酸甲酯,所以水中18O原子来自苯甲酸,反应的化学方程式为:C6H5CO18OH+CH3OH$?_{△}^{浓H_{2}SO_{4}}$C6H5COOCH3+H218O,浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用,
故答案为:C6H5CO18OH+CH3OH$?_{△}^{浓H_{2}SO_{4}}$C6H5COOCH3+H218O;催化剂、吸水剂;
(2)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
(3)苯甲酸甲酯不溶于水,操作Ⅰ分离出互不相溶的液体,通常采用分液操作完成;甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,
故答案为:分液;蒸馏;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,所以不能用NaOH溶液代替饱和碳酸钠溶液,
故答案为:否;氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失;
(5)12.2g苯甲酸的物质的量为:$\frac{12.2g}{122g/mol}$=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol>0.1mol,
则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%.
点评 本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,题目难度中等,明确物质的制备原理为解答此类题的关键,该烃为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
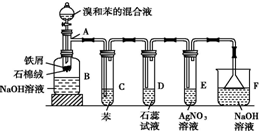 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


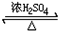 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{pq}{mt}$mol/(L.S) | B. | $\frac{mt}{pq}$mol/(L.S) | C. | $\frac{mp}{qt}$mol/(L.S) | D. | $\frac{tp}{mq}$mol/(L.S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com