
| A. | Na2O2(s)与CO2(g)反应时,放出452kJ热量时,转移电子数为1.204×l023 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ/mol | |
| D. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452kJ/mol |
分析 A、依据Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol分析计算判断;
B、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量分析计算判断;
C、根据盖斯定律利用题给热化学方程式合并消去二氧化碳得到热化学方程式;
D、气态二氧化碳转变成固态要吸热.
解答 解;A、Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol,所以放出452kJ热量时即消耗2molNa2O2,则转移电子数为2moL即1.204×l024,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故B错误;
C、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
,根据盖斯定律合并热化学方程式得到,$\frac{②×2+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=2Na2CO3(s);△H=-509kJ/mol,故C正确;
D、根据热化学方程式为Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol,又气态二氧化碳转变成固态要吸热,则2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写判断,燃烧热的概念应用,反应焓变的意义,盖斯定律的应用.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O | B. | Fe2O3和Fe | C. | Fe2O3 | D. | Fe2O3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
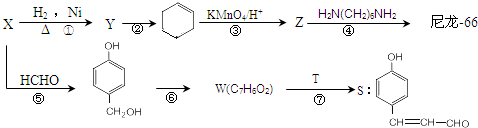
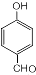 ,T的分子式为C2H4O.
,T的分子式为C2H4O.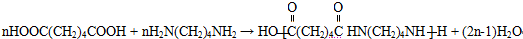 .
.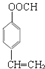 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 | |
| B. | NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 | |
| C. | 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 | |
| D. | 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于试管中,取适量步骤1中的沉淀于试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中. | |
| 步骤4:取适量滤液于烧杯中,用pH计测其 pH值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com