
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3作冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
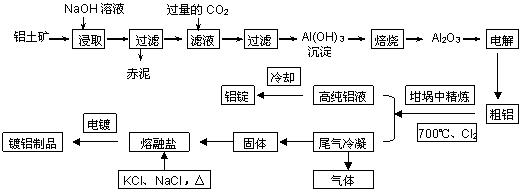
(1)赤泥中的主要成分是 (化学式);向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
科目:高中化学 来源: 题型:
化学实验中,常常用沉淀的方法对同一溶液中的不同阳离子进行分离。
某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用OH-、CO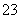 、Cl-三种不同的阴离子分别将上述金属阳离子形成沉淀除去。
、Cl-三种不同的阴离子分别将上述金属阳离子形成沉淀除去。
(1)加入阴离子的顺序是__________________________________________________
________________________________________________________________________。
(2)写出有关反应的离子方程式:__________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氧化物的叙述不正确的是( )
①非金属氧化物不一定属于酸性氧化物 ②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物 ④碱性氧化物都属于金属氧化物
⑤碱性氧化物都能与水反应生成相应的碱
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦与水反应生成含氧酸的氧化物一定是酸性氧化物
⑧不能与酸反应的氧化物一定能与碱反应
A.①②③⑥⑧ B.②③⑤⑦⑧ C.②③⑤⑥⑦ D.②③④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
⑴兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。

①通入Cl2后,观察到的现象是 根据现象可得出的结论是___ __。
②集气瓶B发生反应的离子方程式是______ 。
③C装置的作用是______ ,若有2.24 L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________mol。
⑵兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
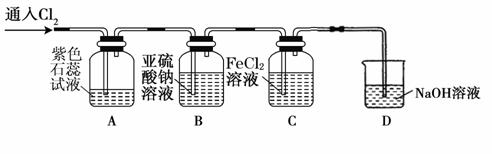
①实验开始后,观察装置A中的现象是: 。
②停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA
B.标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA
C.0.1molN2与足量的H2反应,转移的电子数是0.6NA
D.58.5 g的NaCl固体中含有NA个氯化钠分子
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e- B.O2+4H++4e-=2H2O
C.H2 -2e-=2H+ D.O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中能在溶液中大量共存,且溶液呈碱性透明的是
A、Na+、OH-、H2PO4-、NO3- B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、AlO2-、Na+ D、Fe2+、K+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是 
A.质子数为53、中子数为78的碘原子:131 53I B.S2-的结构示意图:
C.N2的电子式: 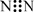 D.NH4I的电子式:
D.NH4I的电子式: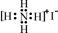
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com