
【题目】含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如下:
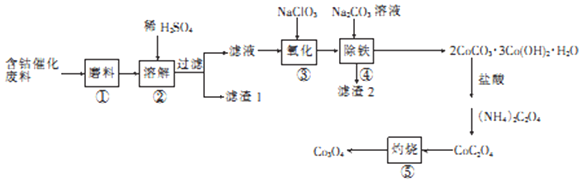
回答下列问题:
(1)CoC2O4中Co的化合价为_____。
(2)步骤②经溶解后过滤,滤渣1的主要成分为____(填化学式),滤液中含有_____种阳离子。
(3)步骤③氧化对Fe2+全部转化为Fe3+,反应的离子方程式为_______,检验其是否已完全氧化自方法是______________。
(4)步骤国加Na2CO3溶液的目的是_____________,滤渣2中含有Na2Fe6(S04)4(OH)x,则x=____,滤渣2中__________(填“含有”或“不含”Al(OH)3。
(5)某工厂用m1kg含钴催化剂废料Co2O3的质量分数为35%)制备Co3O4,最终得到产品m2kg,其产率为________(列出算式即可)。
【答案】 +2 SiO2 和CaSO4 6 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O 取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案) 调节溶液pH以除去Fe3+、Al3+ 12 含有 
【解析】(1)草酸根离子C2O42-,所以Co的化合价为+2价;正确答案:+2。
(2)加入稀硫酸后,二氧化硅不与酸反应,滤渣为二氧化硅及微溶物硫酸钙;含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2,加入稀硫酸后,生成硫酸亚铁溶液、硫酸铁溶液、硫酸钴溶液、硫酸铝溶液;所以,滤液含有:Fe2+ Fe3+ Co3+ Al3+ H+ Ca2+等6种阳离子;滤渣为SiO2、CaSO4。正确答案:SiO2和CaSO4 ; 6 。
中含有6种阳离子。
(3)氯酸钠溶液把亚铁离子氧化为铁离子,本身还原为氯离子;反应的离子方程式为:. 6Fe2++6H++ClO3-=6Fe3++Cl-+3H2O;检验亚铁离子是否完全氧化为铁离子方法,加入酸性高锰酸钾溶液,如果溶液不褪色,氧化完全;正确答案:取少量上层清液,向其中滴加K3[Fe(CN)6]溶液,观察有无蓝色沉淀(或滴入酸性高锰酸钾溶液,振荡,观察溶液紫色是否褪去等合理答案)。
(4)步骤④加Na2CO3溶液的目的是,调整溶液的pH,使铁离子变为沉淀而除去;滤渣2中含有Na2Fe6(S04)4(OH)x,根据化合价法则:Na元素为+1价、Fe为+3价、S042-为-2价,OH-为-1价,所以x=12;根据流程图看出,铝离子也已经沉淀,所以包含Al(OH)3沉淀;正确答案:调节溶液pH以除去Fe3+ ; 12 ; 含有。
(5)根据题给信息,钴元素的量守恒,得到产品的产率为(m2÷241×3)÷(m1×35%÷166) ×2×100%;正确答案:



 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
________________________________________________________________________。
(2)试配平:________Fe2++________Cr2O![]() +________===________Fe3++________Cr3++________H2O
+________===________Fe3++________Cr3++________H2O
(3)若该废水经处理后Cr3+的含量为1×10-2 mol·m-3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm-3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
A.SO2、H2S、Cl2
B.SO2、O2、NH3
C.NO、O2、H2
D.SO2、CO2、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硝酸盐晶体,其化学式为M(NO3)xnH2O,相对分子质量为242g/mol, 取1.21g该晶体溶于水,配成100mL溶液,将此溶液倒入下图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出。在A极得到金属0.32g.下列说法正确的是( )

A. 金属M的摩尔质量为64 B. x=4
C. n=3 D. C极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2﹣1),则下列有关X的说法中正确的是( )
A.其最高正价为+3价
B.其最低负价可能为﹣1价
C.氢化物溶于水,水溶液一定显酸性
D.其最高价氧化物对应水化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)![]() 2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C与水反应可得到B。
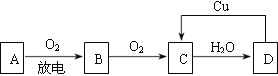
请回答下列问题:
(1)写出B的名称:_______________________。
(2)在上图D→C的过程中,Cu在反应中________(填“被氧化”或”被还原”)。
(3)在D的稀溶液中滴入Na2CO3溶液,其反应的离子方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com