
| A. | 物质的量 | B. | 相对原子质量 | ||
| C. | 物质的摩尔质量 | D. | 12g12C中所含有的C原子数 |
分析 A、由公式n=$\frac{N}{{N}_{A}}$知,NA发生了变化,则n必发生变化;
B、相对原子质量只随其标准的改变而改变,不随阿伏加德罗常数的改变而改变;
C、由于n=$\frac{m}{M}$,M随n的变化而变化;
D、只要物质的质量(或体积)一定,则构成它的粒子数一定.
解答 解:A、由公式n=$\frac{N}{{N}_{A}}$知,NA发生了变化,则n发生变化,故A错误;
B、相对原子质量有它自己的标准(12C原子质量的$\frac{1}{12}$),只随其标准的改变而改变,不随阿伏加德罗常数的改变而改变,故B正确;
C、由于n=$\frac{m}{M}$,而不论对NA如何规定,一定量的物质的质量是不变的,则M=n•m随n的变化而变化,故C错误;
D、只要物质的质量(或体积)一定,则构成它的粒子数一定,不随阿伏加德罗常数的改变而改变,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③⑥ | C. | ②③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| B. | 加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该溶液一定有SO42- | |
| C. | 加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
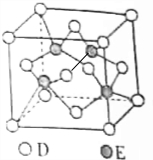 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

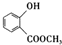 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法利用的是原电池原理 | |
| B. | Fe2+能与[Fe(CN)6]3-反应生成带有特征蓝色的沉淀 | |
| C. | 电解质溶液的导电过程一定是电解质溶液的电解过程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,则Na2CO3溶液的最初浓度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com