
�ڣ�Te��Ϊ��A��Ԫ�أ��ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����ҵ�Ͽɴӵ�⾫��ͭ������������ȡ�ڡ�
��1����ͭ�к���Cu������Zn��Ag��Au��TeO2�������������⾫��������������Ҫ����TeO2�������������ʼ������������⾫����ͭʱ�������缫��ӦʽΪ ��
��2��TeO2���������������ˮ��������ǿ���ǿ�����������������ȡ�ڵ�һ�ֹ����������£�
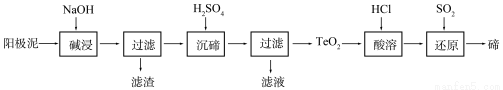
�١������ʱTeO2������Ӧ�Ļ�ѧ����ʽΪ ��
�ڡ����ڡ�ʱ������Һ��pHΪ4.5-5.0������TeO2���������H2SO4��������Һ��ȹ��������ڵij�������ȫ��ԭ���� ����ֹ�ֲ���ȹ���IJ��������� ��
�ۡ����ܡ���SO2ͨ��TeCl4��Һ�н��С���ԭ���õ��ڣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
��1��Zn-2e-=Zn2+ Cu-2e-=Cu2+ ����4�֣���2�֣�
��2���� TeO2+2NaOH=Na2TeO3+H2O ��3�֣�
��TeO2�����������H2SO4�����ᵼ��TeO2������H2SO4��Ӧ������ʧ����3�֣�
��������H2SO4�������Ͻ��� ��3�֣�
�� TeCl4 + 2SO2 + 4H2O=Te + 4HCl + 2H2SO4 ��3�֣�
��������
�����������1����⾫����ͭʱ����ͭ�е�Cu������Zn����������������Ӧ��Zn��Cu���ã���ʧ���ӣ����������缫��ӦʽΪZn-2e-=Zn2+ Cu-2e-=Cu2+
��2����TeO2��������������������Ʒ����������������������Ƶķ�Ӧ����ѧ����ʽΪTeO2+2NaOH=Na2TeO3+H2O��
����ΪTeO2�����������H2SO4�����ᵼ��TeO2������H2SO4��Ӧ������ʧ����ֹ�ֲ���ȹ���IJ��������ǻ�������H2SO4�������Ͻ��裻
��SO2��ԭTeCl4ΪTe������������Ϊ���ᣬ��ѧ����ʽΪTeCl4+2SO2+4H2O=Te+4HCl+2H2SO4
���㣺�����ͭ�����ĵ�ⷴӦʽ����д���Ը��������Ļ�ѧ����ʽ���жϼ���д��ʵ��������ж�


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и�������һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
������̼�����л��ϳ��зdz���Ҫ�ķ�Ӧ�����磺
��Ӧ��
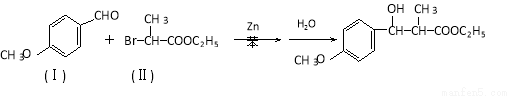
��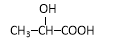 ͨ������·�߿ɺϳ�(��)��
ͨ������·�߿ɺϳ�(��)��
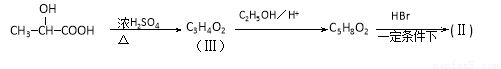
��1�����ķ���ʽΪ ��1mol��������ȫȼ����Ҫ���� mol O2.��
��2������)����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
���Ľṹ��ʽΪ �� �����ɣ���ʱ�����ܵõ���һ�ָ�����C6H8O4���÷�Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ�ķ�Ӧ������ ��
�����ɣ���ʱ�����ܵõ���һ�ָ�����C6H8O4���÷�Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ�ķ�Ӧ������ ��
��4���Զ��ȱ�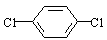 Ҳ�����л���(��) (����)�������Ʒ�Ӧ�ٵ�ϵ�з�Ӧ���������л���Ľṹ��ʽΪ ��
Ҳ�����л���(��) (����)�������Ʒ�Ӧ�ٵ�ϵ�з�Ӧ���������л���Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����и����ڶ��ε��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���ǣ� ��
A������β������NOx ����Ҫ�����Ͳ����ȼ�������
B����������Ʒ���渲��������Ĥ���Խ����𱣻�����
C��ʵ���ҳ��ô�п��ϡ���ᷴӦ��ȡH2
D���Ӻ�ˮ����ȡ��Ĺ����漰������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����з�خ���߿�ͳ����һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�о���Ա�������õ�Ʒλ���̿�(��Ҫ�ɷ���MnO2)�������᳧��β��SO2���Ʊ������̵������������£�
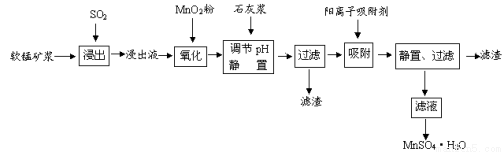
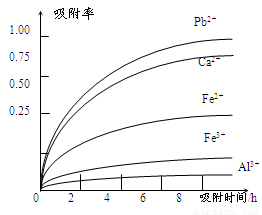
��֪������Һ��pH��2�����еĽ���������Ҫ��Mn2����������������Fe2����Al3����Ca2����Pb2���������������ӡ�PbO2�������Դ���MnO2��PbSO4��һ�������ʡ��йؽ������ӵİ뾶���γ������������ʱ��pH���±��������������������������ӵ�Ч������ͼ��
���� | ���Ӱ뾶(pm) | ��ʼ���� ʱ��pH | ��ȫ���� ʱ��pH |
Fe2�� | 74 | 7.6 | 9.7 |
Fe3�� | 64 | 2.7 | 3.7 |
Al3�� | 50 | 3.8 | 4.7 |
Mn2�� | 80 | 8.3 | 9.8 |
Pb2�� | 121 | 8.0 | 8.8 |
Ca2�� | 99 | �� | �� |
��ش��������⣺
��1��д����������������Mn2+��Ӧ�Ļ�ѧ����ʽ ��
��2��������������Ҫ��Ӧ�����ӷ���ʽ ��
��3�����������Һ���м���ʯ�ҽ������ڵ���pHֵ���˴�����pHֵ�õ��������� ��Ӧ����pH�ķ�ΧΪ ��
��4�������������������ڳ�ȥ���ʽ������ӡ�������ͼ������Ϣ�ش𣬾�������������������Ч���������� �� �ȣ����������ȥ����Ҫ����Ϊ�� ��
��5��CaSO4��һ�������ʣ���֪Ksp(CaSO4)=9.10��10��6���ֽ�c mol��L��1CaCl2��Һ��2.00��10��2 mol��L��1Na2SO4��Һ�������ϣ���������ı仯���������ɳ���ʱ��c����Сֵ�ǡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����з�خ���߿�ͳ����һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ�������£�Al������W������������ˮ�����ϡ��Һ��ȴ��������Ũ��Һ������˵����ȷ���ǣ�������

A��Y������ϼ�Ϊ+6
B�����Ӱ뾶��W��Q��Y��X
C���⻯��ķе㣺Y��Q
D������������ˮ��������ԣ�W��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡ�����б�ҵ���ۺϲ��ԣ��������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��R��ԭ��������������X�����ڰ�����H2���һ��ϲ�������ը��Yλ�ڵ�IA�壬Z������������������������ȣ�WԪ����������������֮��Ϊ0��R��Xͬ�壬��
A��ԭ�Ӱ뾶��Z��Y��X
B��X��R�ĺ˵�������18
C����̬�⻯���ȶ��ԣ�W��R
D��Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡʮУ����������ѧ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��CO2Ϊ̼Դ��ȡ��̼�л����Ϊ�����о����㣬����ΪCO2������ȡ��̼��������ѧ���ݣ�
��Ӧ�� CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = ��49��0 kJ��mol-1
CH3OH(g)+H2O(g) ?H = ��49��0 kJ��mol-1
��Ӧ��2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = ��173��6 kJ��mol-1
CH3CH2OH(g)+3H2O(g) ?H = ��173��6 kJ��mol-1
��1��д����CH3OH(g)�ϳ�CH3CH2OH(g)���Ȼ�ѧ��Ӧ����ʽ��
��2���Է�Ӧ����һ���¶��·�Ӧ�ﵽƽ��ı�־�� ��ѡ����)
a����Ӧ�ﲻ��ת��Ϊ������ b��ƽ�ⳣ��K��������
c��CO2��ת���ʲ������� d����������ƽ����Է����������ٸı䡡
��3�����ܱ������У���Ӧ����һ�������ﵽƽ������������㶨�������CO2ת���ʵĴ�ʩ�� ��ѡ���ţ�
A�������¶� B������CO2 C��������� D����ȥ�״�
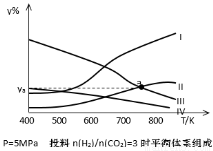
��4���о�Ա�������Ҵ�Ϊ�о��������ܱ������У���H2��CO2�����ʵ���֮��Ϊ3:1����Ͷ�ϣ���5MPa�²�ò�ͬ�¶���ƽ����ϵ�и������ʵ����������y%������ͼ��ʾ����ʾCH3CH2OH��ֵ������� ��ͼ�����ߢ�͢�Ľ���a��Ӧ���������ya= %��������������λ��Ч���֣�
(5)һ���Լ״���ȼ�ϵĵ��ʾ��ͼ��ͼ��д���õ�طŵ�ʱ�����ĵ缫��Ӧʽ�� ��
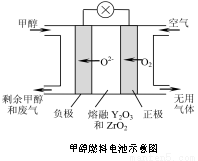
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��ׯ�и�����ѧ�ڵڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����( )
A��Na2S2O3��Һ�м���ϡ���2S2O32����2H��=SO42����3S����H2O
B����������������ϡ���3Fe3O4��28H����NO3�� 9Fe3����NO����14H2O
9Fe3����NO����14H2O
C��100ml0.1mol/L FeI2��Һ������0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D����������Һ�еμ�Ba(OH)2��Һ��ǡ��ʹSO42-������ȫ��2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3��+3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���������У����4���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳ������������ȼ�ϵ�أ�RFC����RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ�ŵ�ء���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ���ǣ��� ��
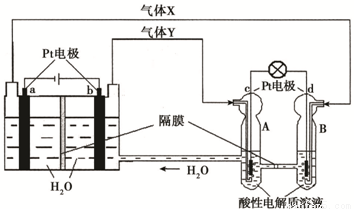
A������0.1 mol����ת��ʱ��a��������״����1.12 L H2
B�����װ���л�ѧ��ת��Ϊ���ܣ��Ҷ�װ���е���ת��Ϊ��ѧ��
C��c���Ϸ����ĵ缫��Ӧ�ǣ�O2 + 2H2O + 4e- �� 4OH��
D��d���Ͻ��л�ԭ��Ӧ���Ҷ�װ��B�е�H+����ͨ����Ĥ����A
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com