
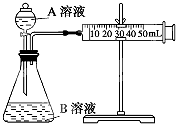
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
分析 (1)根据题中化学方程式改写成离子方程式;
(2)对比①②实验可探究浓度对化学反应速率的影响,对比③④实验可探究温度对化学反应速率的影响,对比②③实验可探究催化剂对化学反应速率的影响,据此分析二氧化碳的体积顺序;
(3)根据v=$\frac{△c}{△t}$列出表达式;从表中数据可知方法不可行;应该统一有颜色的高锰酸钾的量,让草酸过量且浓度不同.
解答 解:(1)题中给出了化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,要拆的物质有高锰酸钾、硫酸、硫酸钾、硫酸锰,离子反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,对比③④实验可探究温度对化学反应速率的影响,温度高,化学反应速率快,二氧化碳含量大,对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,故相同时间内③实验中所得二氧化碳最多,
故答案为:温度、浓度、催化剂;③>④>②>①;
(3)c(KMnO4)=0.01mol/L,与草酸混合后的浓度为:$\frac{4×1{0}^{-3}L×0.01mol•{L}^{-1}}{(4+2)×1{0}^{-3}L}$,从表中3次时间分析,第2次实验误差较大,应舍去这个无效数据,
所以△t=$\frac{14min+14min}{2}$=14min,故v=$\frac{△c}{△t}$=$\frac{4×1{0}^{-3}×0.01}{(4+2)×1{0}^{-3}×14}$mol•L-1•min-1;从表中数据可知浓度小的褪色时间反而短,是因为草酸过量,高锰酸钾的量太少的原因所致,所以不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系,不可行;应该统一有颜色的高锰酸钾的量,让草酸过量且浓度不同,
故答案为:$\frac{4×1{0}^{-3}×0.01}{(4+2)×1{0}^{-3}×14}$mol•L-1•min-1;不可行;取过量且同体积、不同浓度的草酸和同体积同浓度的KMnO4酸性溶液反应.
点评 本题考查影响化学反应速率的因素,用控制变量法进行探究,实验设计这个小题比较新颖,考查学生灵活运用所学知识进行数据分析和处理,有一定难度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题


| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
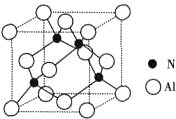 由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.
由N元素和Al元素形成的化合物的晶胞如图所示,已知N原子位于晶胞体对角线的$\frac{1}{4}$处.假设该化合物的密度为ρg•cm-3,则晶胞中最近的两个N原子之间的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{164}{{N}_{A}ρ}}$.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
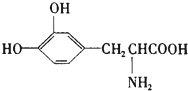 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
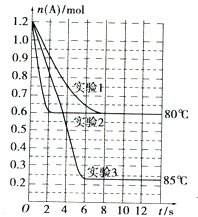 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
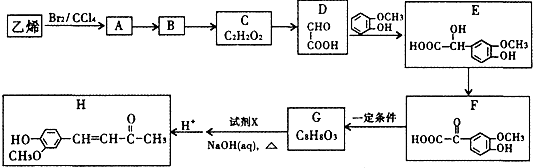

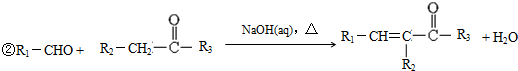
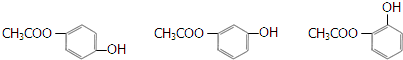 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com