
分析 X的单质在Z的单质中燃烧,生成A,燃烧时火焰呈苍白色,并且A极易溶于水,其水溶液可使蓝色石蕊试纸变红,说明X单质为H2,Z单质为Cl2,A为HCl;
每2个X2分子可与1个Y2分子化合生成2个B分子,B在常温下为液体,说明Y单质为O2,B为H2O;Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用,
细铁丝能在Z2(Cl2)中剧烈燃烧,且产生棕褐色烟W,W为FeCl3,以此解答该题.
解答 解:X的单质在Z的单质中燃烧,生成A,燃烧时火焰呈苍白色,并且A极易溶于水,其水溶液可使蓝色石蕊试纸变红,说明X单质为H2,Z单质为Cl2,A为HCl,
每2个X2分子可与1个Y2分子化合生成2个B分子,B在常温下为液体,说明Y单质为O2,B为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用,
细铁丝能在Z2(Cl2)中剧烈燃烧,且产生棕褐色烟W,W为FeCl3,
(1)由以上分析可知X为氢、Z为氯,
故答案为:氢;氯;
(2)根据分析可知,B为H2O,W为FeCl3,
故答案为:H2O;FeCl3;
(3)反应②为氢气与氯气的反应,生成氯化氢,反应的方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
⑤为氯气和水的反应,生成盐酸和次氯酸,反应的方程式为:Cl2+H2O═HCl+HClO,
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;Cl2+H2O═HCl+HClO;
(4)Z2(g)为氯气,实验室制取氯气的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重于学生的分析能力的考查,抓住明显特征,入手分析可得答案.“火焰为苍白色”可推知是H2在Cl2中燃烧.由③可推出X+是H+,Z-是Cl-,根据④的描述,可判断是H2和O2的反应.根据⑤可知有HClO生成,⑥为Fe在Cl2中的燃烧,题目难度中等.


科目:高中化学 来源: 题型:推断题
 ;
; ;它的一种同素异形体是O3.(写化学式)
;它的一种同素异形体是O3.(写化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在氯气中燃烧,产生白烟 | |
| B. | 将氯水滴入紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用pH试纸测得0.1mol•L-1硫酸铝溶液显中性 | |
| D. | 向新切土豆上滴加碘水,土豆片上显示蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )| A. | 石墨电极与电源的正极相连 | |
| B. | 刚开始电解时,左侧溶液的pH增大 | |
| C. | 电解结束时,右侧溶液中含有I- | |
| D. | 电解槽内发生反应的总化学方程式为2KI+2H2O═I2+H2↑+2KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①③④ | C. | ④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
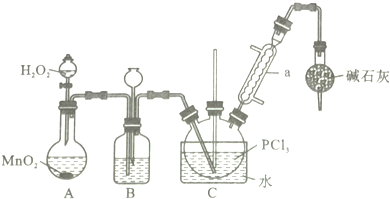
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
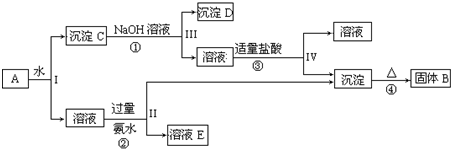
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com