
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及部分记录)
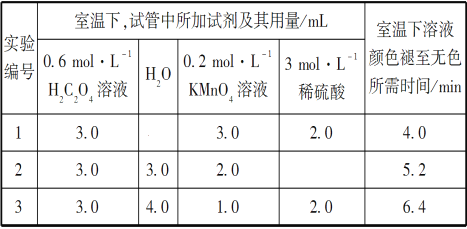
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
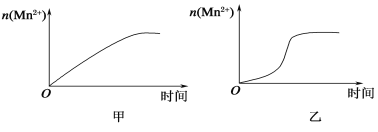
①该小组同学提出的假设是__________________________。
②请你帮助该小组同学完成实验方案,并填写表所加固体的化学式_______。
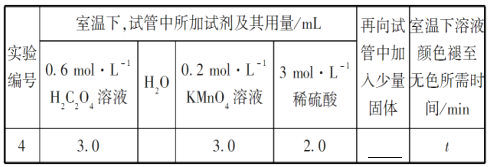
③若该小组同学提出的假设成立,t的大小范围是__________________________。
【答案】其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大1.5×10-2 mol·L-1·min-1生成物中的MnSO4为该反应的催化剂[或Mn2+对该反应有催化作用]MnSO4(t)小于4 min]
【解析】
本题主要结合实验考查了影响反应速率的因素,注意掌握温度、浓度、催化剂对反应速率的影响,解题的关键是对比分析图表中的数据找出相同点和不同点,然后得出结论。
(1)从表中数据可以改变的条件是高锰酸钾溶液的浓度,其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大。(2)草酸的物质的量为0.6×0.003=0.0018mol,高锰酸钾的物质的量为0.2×0.003=0.0006mol,草酸和高锰酸钾的物质的量比为0.0018:0.0006=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为0.2×0.003/(3+2+3+2)=0.06mol/L,这段时间内平均反应速率为0.06/4= 1.5×10-2 mol·L-1·min-1。 (3) ①由图乙可知反应开始后速率增大的比较快,说明生成物中的硫酸锰为该反应的催化剂或Mn2+对该反应有催化作用。②与实验1对比实验,则加入的硫酸锰的量不同,其他条件必须相同,所以加入的少量固体为硫酸锰。③若该小组同学提出的假设成立,则反应速率加快,溶液的褪色时间小于4 min。


科目:高中化学 来源: 题型:
【题目】铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L氢气(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为
A.0.2molB.0.1molC.0.05molD.0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、SO42- , 现取两份100mL溶液进行如下实验: ①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。②第二份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测不正确的是( )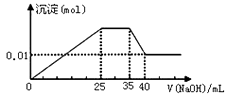
A.原溶液一定不存在Cu2+
B.不能确定原溶液是否含有K+
C.实验所加的NaOH的浓度为2mol·L-1
D.原溶液确定含Mg2+、Al3+、NH4+ , 且n(Mg2+) ∶n(Al3+)∶n( NH4+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊方法把固体物质加工到纳米级(1nm—100nm)的超细粉末粒子,然后制得纳米材料。下列分散质粒子直径具有与此相同数量级的是( )
A.淀粉溶液B.泥水C.酒精D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,不能形成π键的是( )
A. 1s22s22p63s23p4 B. 1s22s22p3
C. 1s22s22p63s1 D. 1s22s22p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: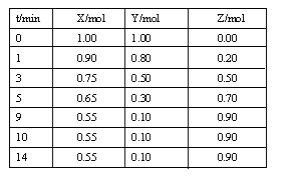
(2)体系中发生反应的化学方程式是;
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率;
(4)该反应达到平衡时反应物X的转化率α等于;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如下图所示)。则曲线①、②、③所对应的实验条件改变分别是:① ②③。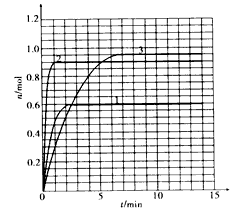
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是
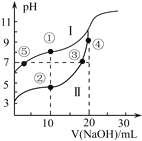
A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示。下列说法不合理的是
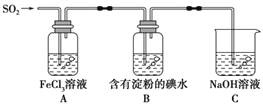
A. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
B. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
C. 装置C的作用是吸收SO2尾气,防止污染空气
D. 为了验证A中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是。工业上分离这些多氯代甲烷的方法是。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构)。
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:![]()
反应①的化学方程式是 ,
反应类型为 , 反应②的反应类型为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com