
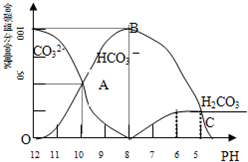
 常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示.回答下列问题:
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示.回答下列问题:

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12LNO与1.12O2的混合物中含有的原子数为0.2NA |
| C、Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.2NA |
D、32gS8单质中含有的S-S键个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| B、用双氧水和稀硫酸可以雕刻印刷电路板:Cu+H2O2+2H+=Cu++2H2O |
| C、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 |
| D、澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O. |
查看答案和解析>>
科目:高中化学 来源: 题型:
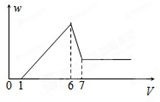 使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )
使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )| A、2:3 | B、1:1 |
| C、4:3 | D、8:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
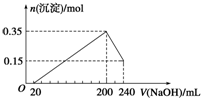
 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的| A、2mol、3mol、6mol |
| B、3mol、2mol、6mol |
| C、2mol、3mol、4mol |
| D、3mol、2mol、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
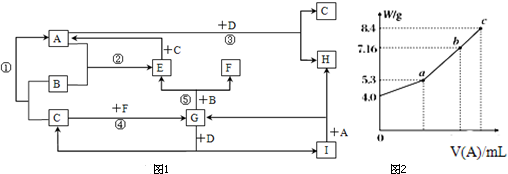
 Ⅰ.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成;请填空:
Ⅰ.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.取适量A进行铝热反应,产物中有单质B生成;请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 C2H4 |
| B、CH3OH CH3COOH |
| C、C2H6 HCHO |
| D、HCHO CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr
某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com