
 CaCl2
CaCl2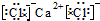 Na2O2
Na2O2 OH-
OH- CH3-
CH3- NaOH
NaOH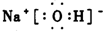
 .
. .
. .
. 分析 水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
氯化钙为离子化合物,阴阳离子需要标出电荷,氯离子还要标出最外层电子;
过氧化钠是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
OH-是阴离子原子团,应标注出最外层的电子;
甲基中碳原子与3个H原子形成3条共价键,碳原子还有一个未成对的孤电子;
氢氧化钠为离子化合物,钠离子和氢氧根离子需要标出所带电荷,氢氧根离子需要标出原子的最外层电子.
硫化钠为离子化合物,根据离子化合物的电子式结合电子转移然后写出Na2S的形成过程;
MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到;
二氧化碳为共价化合物,根据共价化合物电子式的表示方法用电子式表示出CO2的形成过程.
解答 解:水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ;
;
氯化钙为离子化合物,电子式中需要标出阴阳离子所带电荷,氯化钙的电子式为: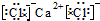 ;
;
Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ;
;
OH-是阴离子原子团,应标注出最外层的电子,H原子和O原子间为共价键,故氢氧根的电子式为: ;
;
甲基中碳原子与3个H原子形成3条共价键,碳原子还有一个未成对的孤电子,即甲基中碳原子最外层为7个电子,甲基的电子式为: ;
;
氢氧化钠属于离子化合物,钠离子直接用离子符号表示,氢氧根离子除了标出所带电荷,还需要写出O、H的最外层电子,氢氧化钠的电子式为: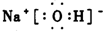 .
.
硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ;
;
MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ;
;
二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: .
.
故答案为: ;
;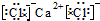 ;
; ;
; ;
; ;
;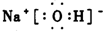 ;
; ;
; ;
; .
.
点评 本题考查了电子式、结构式、用电子式表示离子化合物、共价化合物的形成过程,题目难度中等,注意掌握电子式、结构式的表示方法,能够用电子式表示共价化合物和离子化合物的形成过程.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 化学反应 | 加成反应 | 乙酸酯化 | 乙醇酯化 | 乙醇的催化氧化 |
| A | C=C | C-O | O-H | C-H、O-H |
| B | C=C | C-O | O-H | C-O |
| C | C-C | C=O | C-O | C-H |
| D | C=C | C-O | C-O | C-C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮及其化合物与人们的生活息息相关,请回答下列有关问题.
氮及其化合物与人们的生活息息相关,请回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. 、
、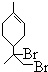 .(用键线式表示)
.(用键线式表示)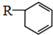 (R代表烃基),可能的结构共有4种.
(R代表烃基),可能的结构共有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
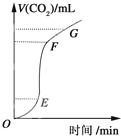
| A. | OE段表示反应速率最快 | |
| B. | EF段表示反应速率最快,收集的CO2最多 | |
| C. | FG段表示收集的CO2最多 | |
| D. | OG段表示随着时间的推移,反应速率逐渐增快 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
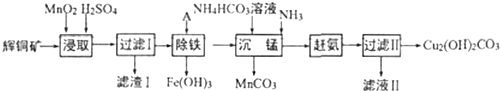
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com