
科目:高中化学 来源: 题型:阅读理解

 化合
化合查看答案和解析>>
科目:高中化学 来源: 题型:
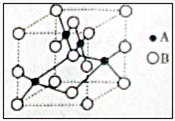 (2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.
(2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
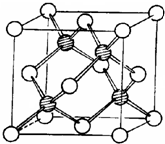 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.查看答案和解析>>
科目:高中化学 来源: 题型:
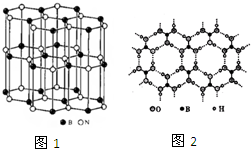 尿素(
尿素(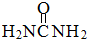 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com