
分析 Ⅰ.(1)A与SO2属于等电子体,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析元素组成,硫和氧化铜反应生成黑色固体是铜的化合物,判断为CuS,结合原子守恒和电子守恒配平化学方程式;
(2)将S2Cl2与CuO在100~400℃加热时也能生成A,依据(1)的判断A为S2O,结合原子守恒配平化学方程式;
(3)A也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸;
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N.
(1)分析判断E是Na3N,属于离子化合物;
(2)水分子间形成氢键,增大物质溶沸点;
(3)E与X反应生成氢氧化钠和氨气;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,B与C反应生成D和是碳酸氢钠与氢氧化钠反应生成碳酸钠与水;
解答 解:Ⅰ.(1)A与SO2属于等电子体,常温下是一种无色的气体,当冷却到77K时,变成橙红色液体.A的一种制备方法是:在真空中,将CuO和硫一起混合加热,可生成A,同时生成一种黑色固体B,分析组成元素生成的黑色固体只能为CuS,原子守恒配平得到化学方程式为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$ S2O+CuS;
故答案为:CuO+3S$\frac{\underline{\;\;△\;\;}}{\;}$ S2O+CuS;
(2)将S2Cl2与CuO在100~400℃加热时也能生成S2O,硫元素、氧元素化合价不变,则发生的不是氧化还原反应,反应生成S2O和CuCl2,反应的化学方程式为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
故答案为:S2Cl2+CuO $\frac{\underline{\;100℃-400℃\;}}{\;}$S2O+CuCl2;
(3)S2O也能在水中发生歧化反应,生成两种常见的酸(但酸性都不强),说明是硫元素化合价升高和降低,升高为+4价,降低为-2价,对应酸为亚硫酸和氢硫酸,这两种酸由强到弱的化学式分别H2SO3,H2S;
故答案为:H2SO3,H2S;
Ⅱ.A是有机羧酸盐HCOONa,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2中的一种,由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3,即2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O,故X为H2O,Y为CO2.E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g•L-1,可知气体Z的相对分子质量=0.76×22.4=17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,可确定E是Na3N.
(1)上述分析可知E为Na3N,属于离子化合物含有离子键,故答案为:离子键;
(2)X为H2O,水分子之间存在氢键,沸点高于同主族同类型物质,故答案为:水分子之间存在氢键;
(3)E与X反应生成氢氧化钠和氨气,反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑;
故答案为:Na3N+3H2O=3NaOH+NH3↑;
(4)D为Na2CO3,其饱和溶液中不断通入CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
B与C反应生成D和是碳酸氢钠与氢氧化钠反应生成碳酸钠与水,离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;HCO3-+OH-=CO32-+H2O.
点评 本题考查无机物推断,是对学生综合能力的考查,充分利用题目信息进行推断,物质性质和结构分析是关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
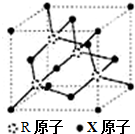 X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成  ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到  .
.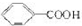 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是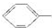 CH2CH2CH2CH2,
CH2CH2CH2CH2,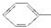 CH(CH2)CH2CH2CH2,
CH(CH2)CH2CH2CH2, CH2CH(CH2)CH2CH2
CH2CH(CH2)CH2CH2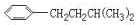 、
、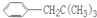 、
、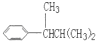 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
关于SO2的叙述中,正确的是
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温 常压下,1molSO2的体积为22.4L
常压下,1molSO2的体积为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com