
【题目】某小组欲探究反应2Fe2+ + I2![]() 2Fe3+ + 2I,完成如下实验:
2Fe3+ + 2I,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,______。
(2)Ⅲ中的黄色浑浊是______。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于______(用离子方程式表示),可产生Fe3+;
假设b:溶液中Ag+具有氧化性,可产生Fe3+;
假设c: ______;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是______。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,______。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1 mL 0.1 mol·L1 FeSO4溶液中加入1 mL0.1 mol·L1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是______。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是______。
【答案】滴加几滴KSCN溶液,溶液不变红 AgI 4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 酸性溶液中NO3具有氧化性,可产生Fe3+ Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++ I2 ![]() 2Fe3++ 2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2+ + Ag+== Fe3+ + Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
2Fe3++ 2I正向移动,使I2氧化了Fe2+ 加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成 Fe2+ + Ag+== Fe3+ + Ag AgI分解产生的Ag催化了Fe2+与Ag+的反应
【解析】
(1)根据检验Fe3+的实验方法分析解答;
(2)根据资料黄色固体AgI不溶于稀硝酸,结合图示分析判断;
(3)①Fe2+ 被O2氧化生成Fe3+,据此书写反应的离子方程式;酸性溶液中NO3具有氧化性;②根据试管III中的现象,Ag+与I生成了AgI沉淀,结合2Fe2++ I2 ![]() 2Fe3++ 2I分析解答;
2Fe3++ 2I分析解答;
(4)①检验灰黑色浑浊物AgI中含有Ag,可以利用AgI不溶于稀硝酸,而Ag能够溶于稀硝酸设计实验检验;
②ⅰ.实验1中Fe2+ 和Ag+发生氧化还原反应,据此书写反应的离子方程式;ⅱ.由实验1的图示可知,5-10min,银离子浓度下降很快,说明有催化剂在影响反应;由实验2知,Fe3+ 没有起催化剂作用,结合试管III、Ⅳ中的现象分析解答。
(1)根据检验Fe3+的实验方法可知,滴加几滴KSCN溶液,溶液不变红,说明溶液中不存在Fe3+,故答案为:滴加几滴KSCN溶液,溶液不变红;
(2)由资料可知,黄色固体AgI不溶于稀硝酸,结合图示可知,黄色沉淀为AgI,故答案为:AgI;
(3)①Fe2+ 被O2氧化生成Fe3+,反应的离子方程式为4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O,酸性溶液中NO3具有氧化性,也可将Fe2+氧化生成Fe3+,故答案为:4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O;酸性溶液中NO3具有氧化性,可产生Fe3+;
②结合已知信息:2Fe2++ I2 ![]() 2Fe3++ 2I,和试管III中的现象,Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++ I2
2Fe3++ 2I,和试管III中的现象,Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++ I2 ![]() 2Fe3++ 2I正向移动,使I2氧化了Fe2+,故答案为:Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++ I2
2Fe3++ 2I正向移动,使I2氧化了Fe2+,故答案为:Ag+与I生成了AgI沉淀,降低了I的浓度,使平衡2Fe2++ I2 ![]() 2Fe3++ 2I正向移动,使I2氧化了Fe2+;
2Fe3++ 2I正向移动,使I2氧化了Fe2+;
(4)①检验灰黑色浑浊物AgI中含有Ag,可以利用AgI不溶于稀硝酸,而Ag能够溶于稀硝酸,使银转化为银离子,再检验银离子即可,具体操作为:加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成,说明AgI中含有Ag,故答案为:加入足量稀硝酸,振荡,固体部分溶解,产生无色气泡,遇空气变红棕色。静置,取上层清液加入稀盐酸,有白色沉淀生成;
②ⅰ.实验1中Fe2+ 和Ag+发生氧化还原反应,反应的离子方程式为Fe2+ + Ag+= Fe3+ + Ag;ⅱ.由实验1的图示可知,5-10min,银离子浓度下降很快,说明有催化剂在影响反应;由实验2知,Fe3+ 没有起催化剂作用,结合试管III、Ⅳ中的现象可推知,AgI分解产生的Ag催化了Fe2+与Ag+的反应,从而加快了Fe2+与Ag+的反应速率,使得Ⅳ中迅速出现灰黑色浑浊,故答案为:Fe2+ + Ag+= Fe3+ + Ag;AgI分解产生的Ag催化了Fe2+与Ag+的反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】⑴有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为______mol/L。
⑵下列微粒:①S ②SO32- ③ Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是______![]() 填序号
填序号![]() ,只能表现出氧化性的是______
,只能表现出氧化性的是______![]() 填序号
填序号![]() 。
。
⑶一定条件下, PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为______mol;
⑷在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为______。
⑸自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2发生的反应可表示如下,请完成方程式的配平。____Al + ____NO3-+ ________ == ____AlO2- + ____N2↑ +____ H2O,
⑹某化学反应的反应物和产物:![]()
①该反应的氧化产物是______。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4 + KI + H2SO4→______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:

(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若H与C反应固体增重4.2 g,则参加反应的C气体在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(AlP)熏蒸杀虫,AlP遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05mg·kg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100g原粮,E中加入20.00mL 2.50×10-4mol·L-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
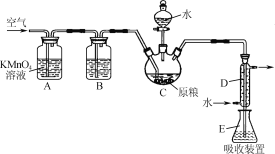
(1)装置A中的KMnO4溶液的作用是________。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量________(填“偏高”“偏低”或“不变”)。
(3)装置E中PH3被氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:________。
(4)收集装置E中的吸收液,加水稀释至250mL,量取其中的25.00mL于锥形瓶中,用4.0×10-5 mol·L-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00 mL,反应原理是SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平)。通过计算判断该样品是否合格(写出计算过程)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起_______的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂 除去。
(5)写出烧瓶a中发生反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:υ(H2)=1 mol·L-1·min-1;乙:υ(N2)=2 mol·L-1·min-1;丙:υ(NH3)= 3 mol·L-1·min-1。则三个容器中合成氨的反应速率
A. υ(甲)>υ(乙)>υ(丙) B. υ(乙)>υ(丙)>υ(甲)
C. υ(丙)>υ(甲)>υ(乙) D. υ(乙)>υ(甲)>υ(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com