
| A. | ①④ | B. | ②④ | C. | ①②③ | D. | ①②③④⑤ |
分析 ①铵根离子中不存在金属原子;
②非金属原子能形成阳离子,如铵根离子;
③阳离子的电子排布不一定与稀有气体相同,如氢离子;
④阳离子的价态可能大于其原子的最外层电子数;
⑤阳离子不都是稳定结构,可能会再失去电子.
解答 解:①阳离子不一定是由一个金属原子失去电子而形成的,如铵根离子,故①错误;
②铵根离子为阳离子,所以非金属原子也可以形成阳离子,故②错误;
③氢离子核外电子数为0,所以阳离子的电子排布不一定与稀有气体相同,故③错误;
④阳离子的价态可能大于其原子的最外层电子数,如铁的最外层电子数为2,可以为+2价,+3价,故④错误;
⑤阳离子不都是稳定结构,可能会再失去电子,如亚铁离子,故⑤错误;
故选D.
点评 本题考查原子结构与性质,题目难度不大,明确阴阳离子构成特点为解答关键,易错选项是①,非金属原子也能形成阳离子,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
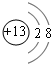 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 溶剂蒸发的速率越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 油脂在热NaOH溶液中完全水解后加入饱和食盐水,可观察到液面上有固体析出 | |
| D. | 制备NaCl晶体时,晶体表面含有少量KNO3,用水淋洗后可得到较纯净的NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
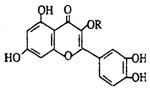
| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HNO3>H2CO3 | D. | 相对原子质量:Ar>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
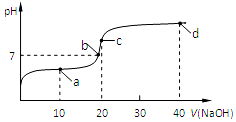 室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-) | |
| C. | c点时:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
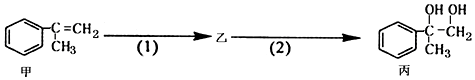
| A. | 物质丙能与氢氧化钠溶液反应 | |
| B. | 甲和丙均可使酸性KMnO4溶液褪色 | |
| C. | 反应(2)属于取代反应 | |
| D. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
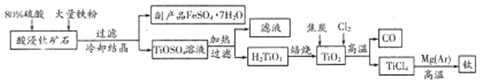
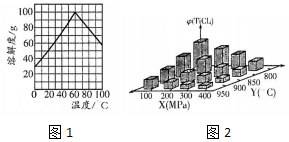
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35L | B. | 30L | C. | 25L | D. | 20 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com