
科目:高中化学 来源: 题型:
| A、一个化学反应是否能在常温下发生,与该反应的△H值的大小没有必然联系 | B、中和热△H=-57.3kJ?mol-1,所以1.00L 1.00mol?L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 | C、用等体积的0.50mol?L-1盐酸、0.55mol?L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | D、在101kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
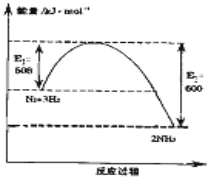 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
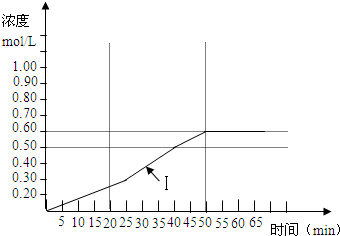
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 浓度(mol/L) |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
查看答案和解析>>
科目:高中化学 来源:2013届福建师大附中高二上学期期末考试化学试卷 题型:选择题
下列有关反应热的说法中正确的是
A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ•mol-1,所以,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰
好完全反应放出57.3kJ的热量
C.用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验与
用等体积的0.50mol•L-1盐酸、0.50mol•L-1NaOH溶液进行中和热测定的实验相比,前者会使测得的中和热的数值偏大
D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应热的说法中正确的是
A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ•mol-1,所以,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰
好完全反应放出57.3kJ的热量
C.用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验与
用等体积的0.50mol•L-1盐酸、0.50mol•L-1NaOH溶液进行中和热测定的实验相比,前者会使测得的中和热的数值偏大
D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com