
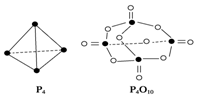
 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
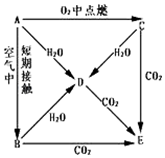 A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
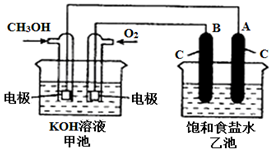 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 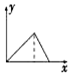 | B. | 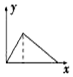 | C. | 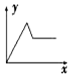 | D. | 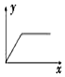 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com