
����Ŀ������ʵ���������������۶�Ӧ��ϵ��ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ʢ��Fe(NO3)2��Һ���Թ��м���0.1 mol��L��1H2SO4��Һ | �Թܿڳ��ֺ���ɫ���� | ��Һ��NO |
B | ��2 mL 1 mol/L NaOH��Һ���ȼ���3��1 mol/L MgCl2��Һ���ټ���3��1 mol/L FeCl3��Һ | �ȳ��ְ�ɫ�����������ɺ��ɫ���� | ֤��Mg(OH)2��������ת��ΪFe(OH)3���� |
C | �ڵ��з�̪��Na2CO3��Һ�У� ����BaC12 | ��Һ��ɫ��ȥ | CO32-����Һ�д���ˮ��ƽ�� |
D | �����£��ⶨ����ʹ�����Һ��pH | ����pHС�ڴ���pH | ֤����ͬ�����£���ˮ��HCl����̶ȴ���CH3COOH |
A.AB.BC.CD.D
���𰸡�C
��������
A.��ʢ��Fe(NO3)2��Һ���Թ��м���0.1 mol��L��1H2SO4��Һ����Һ��NO![]() ��Fe2����ԭΪNO��NO���ȶ��������е�������������NO2�������Թܿڳ��ֺ���ɫ���壬��A����
��Fe2����ԭΪNO��NO���ȶ��������е�������������NO2�������Թܿڳ��ֺ���ɫ���壬��A����
B. ��2 mL 1 mol/L NaOH��Һ���ȼ���3��1 mol/L MgCl2��Һ���ȳ��ְ�ɫ����Mg(OH)2���ټ���3��1 mol/L FeCl3��Һ�������ɺ��ɫ����, ����֤��Mg(OH)2��������ת��ΪFe(OH)3��������ΪNaOH��Һ�����ģ���B����
C.�ڵ��з�̪��Na2CO3��Һ�У�����BaC12������ɫ��������Һ��ɫ��ȥ������ΪCO32-+H2O![]() HCO3-+OH-��CO32Ũ�ȼ�С��ˮ��ƽ�������ƶ�����C��ȷ��
HCO3-+OH-��CO32Ũ�ȼ�С��ˮ��ƽ�������ƶ�����C��ȷ��
D. �����£��ⶨ����ʹ�����Һ��pH��û��˵����ͬŨ�ȵ�����ʹ�����Һ���������Ƚϣ���D����
��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����׳Ʋ��ᣨ�ṹ��ʽΪHOOC��COOH���ɼ�дΪH2C2O4��������һ����Ҫ�Ļ���ԭ�ϡ���������0.01 mol/L��H2C2O4��KHC2O4��K2C2O4��Һ��pH�����ʾ������գ�
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)д��H2C2O4�ĵ��뷽��ʽ________________��
(2)KHC2O4��Һ�����Ե�ԭ����_________________����0.1 mol/L�IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
a��c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b��c(Na+)=c(H2C2O4)+c(C2O42-)
c��c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d��c(K+)>c(Na+)
(3)H2C2O4�����Ը��������Һ��Ӧ��������������(CO2)��������ɫ��ʧ��д����Ӧ�����ӷ���ʽ____________________����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��F�Ǽ��ֳ��������ķ������ģ�ͣ�������Щģ�ͻش��������⣺

(1)�����º�̼����ߵ�Һ̬����___________��
(2)�ܹ������ӳɷ�Ӧ����Ϊ____________��
(3)һ�ȴ����ͬ���칹��������___________(�������Ӧ��ĸ)��
(4)��C�Ʊ��ۺ���ķ�Ӧ����Ϊ____________��
(5)�л���G��H��E������ͬʵ��ʽ������G��Է���������E��Է���������![]() ��H��Է���������E��Է���������
��H��Է���������E��Է���������![]() ��G����ʹ��ˮ��ɫ��ֻ��һ�ֻ����⣬G�Ľṹ��ʽΪ_________��H�Ƿ��㻯�����ʹ��ˮ��ɫ��H�Ľṹ��ʽΪ_________��
��G����ʹ��ˮ��ɫ��ֻ��һ�ֻ����⣬G�Ľṹ��ʽΪ_________��H�Ƿ��㻯�����ʹ��ˮ��ɫ��H�Ľṹ��ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d���ֶ�����Ԫ�������ڱ��зֲ���ͼ��ʾ������˵����ȷ���ǣ�������
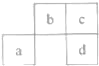
A.������Ԫ�ؾ�Ϊ����Ԫ�أ���dԪ�ص�ԭ�Ӱ뾶���
B.��b��������ռ�������������a�ĵ��ʿ�����ұ������
C.��aΪ�ǽ���Ԫ�أ���c����̬�⻯���ˮ��Һ���ܳʼ���
D.��a�����������δ�ɶԵ��ӣ���d�ĵ��ʳ����²�����Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ϩ������ںϳ����������㣬���Լױ�Ϊԭ�ϣ������з����ϳɣ���F��ʼ�������ϳ�·�ߣ�

��֪����CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
��CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
���������գ�
(1)д��D�Ľṹ��ʽ______��
(2)д����Ӧ���ͣ���Ӧ��______��
(3)д����Ӧ����Ҫ�Լ�����������Ӧ��______����Ӧ��______��
(4)д��һ����������������D��ͬ���칹��Ľṹ��ʽ______��
���ܷ���������Ӧ
������FeCl3��Һ������ɫ��Ӧ
�۷�������5�ֲ�ͬ��ѧ��������ԭ��
(5)����E�Ƿ���ȫת��ΪF�ķ�����______��
(6)·�߶���·��һ��Ȳ�̫���룬������______��
(7)������֪���������һ����![]() �Ʊ�
�Ʊ�![]() �ĺϳ�·��_________________�����ϳ�·�ߵı�ʾ����Ϊ��A
�ĺϳ�·��_________________�����ϳ�·�ߵı�ʾ����Ϊ��A![]() B��
B��![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�������ж�����ȷ����
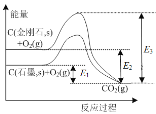
A.ʯī��O2����CO2�ķ�Ӧ�����ȷ�Ӧ
B.�������ʯ��ʯī��ȫȼ�գ����ʯ�ų���������
C.�������Ƕȿ������ʯ��ʯī���ȶ�
D.C(���ʯ��s) = C(ʯī��s) + Q kJ Q= E3��E2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��ԭ�Ӱ뾶����Դ�С��������ۻ��������ԭ�������ı仯��ϵ��ͼ��ʾ��

����˵����ȷ����
A. ���Ӱ뾶�Ĵ�С˳��e��f��g��h
B. ��x�γɼ�����ķе㣺y��z��d
C. x��z��d����Ԫ���γɵĻ�������ܺ������Ӽ�
D. e��f��g��h����Ԫ�ض�Ӧ����������ˮ�����֮����ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����(�����Ƽ)�Ͱ�����������̼�Ҫ��ʾ���£�

���������գ�
(1)д����ѧʽ����_____����____
(2)�������Ϸ������������������_____(ѡ������Ҫ����������Ҫ��)���䰱����д���ù���������CaCl2�Ļ�ѧ����ʽ________________��
(3)������д�ĸҺ����ȡ�Ȼ�茶���Ĺ��̽��з��������ý��ۺ�������______��
a������ʱ�Ȼ�淋��ܽ�ȱ��Ȼ���С
b��ͨ�백���ɰ�̼������ת��Ϊ̼���ƣ���ֹ̼����������
c������ʳ��ϸ��Ŀ�������Na+��Ũ�ȣ��ٽ�̼�����ƽᾧ����
(4)ȡ�������Ƽ�������Ĵ�����Ʒ5.500g�����500mL��Һ��ȡ25mL��Һ��0.1000mol/L�ı�����ζ�(�����е����ʲ������ᷴӦ)���÷�̪��ָʾ�������εζ����������ƽ����Ϊ25.00mL��������Ʒ�д������������______��(��֪25��ʱ0.1mol/L��NaHCO3��Һ��pHԼΪ8.3)ij�С����������Ƽ�ԭ������������ʾװ��(�г�װ��ʡ��)�Ʊ�̼�����ƣ�
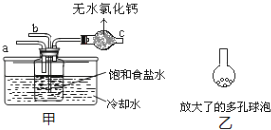
(5)ʵ��ʱ�����ȴ�____��ͨ��_____���壬�ٴ�_____����ͨ��_____���塣
(6)��ͬѧ�����ڼ�װ�õ�b���¶�������װ�ã�Ŀ����________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۱�ϩ��ĵ����DZ�ϩ�棨CH2��CHCN������ϳɷ����ܶ࣬������ȲΪԭ�ϣ���ϳɹ��̵Ļ�ѧ��Ӧ����ʽ���£�
��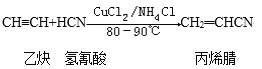
��CH2=CHCN�� (�۱�ϩ��)
(�۱�ϩ��)
�ش��������⣺
��1���Ʊ��۱�ϩ��ķ�Ӧ������___��
��2���۱�ϩ���е�����������Ϊ__��
��3����μ���ijƷ�Ƶ���ë������ë���ǡ�������ë����__��
��4���������ϲ��Ϸ������۱�ϩ�������ͽṹ�������ͽṹ��__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com