
| 选项 | 应用 | 解释 |
| A | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝与氧气不反应 |
| D | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯为催熟剂,可被高锰酸钾氧化;
B.钢铁闸门上装一定数量的锌块,形成原电池反应;
C.铝为活泼金属,易与氧气反应;
D.硅为亲氧元素,自然界中不存在单质硅.
解答 解:A.乙烯为催熟剂,含有碳碳双键,可被高锰酸钾氧化,则用浸泡过高锰酸钾溶液的硅藻土保鲜水果,故A正确;
B.钢铁闸门上装一定数量的锌块,形成原电池反应,没有外加电源,则不是外加电流的阴极保护法,故B错误;
C.铝为活泼金属,易与氧气反应,高铁车厢采用铝合金材料,与合金的耐腐蚀有关,且铝与氧气反应在表面形成一层致密的氧化膜,故C错误;
D.硅为亲氧元素,自然界中不存在单质硅,故D错误.
故选A.
点评 本题考查较为综合,涉及乙烯、金属的腐蚀、合金等知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
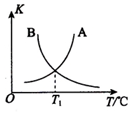 乙苯(
乙苯(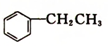 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途. (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

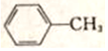 ,G的名称是苯甲醛.
,G的名称是苯甲醛.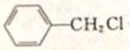 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$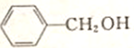 +NaCl.
+NaCl. .
. 以物质的量之比2:1反应得到化合物的结构简式为
以物质的量之比2:1反应得到化合物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com