
分析 无色透明溶液,则一定不含Fe3+,
①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子,;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡,以此来解答.
解答 解:无色透明溶液,则一定不含Fe3+,
①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子,;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡,
(1)综上所述,一定含Al3+、NO3-、SO42-,一定不存在Fe3+、Ba2+、HCO3-,故答案为:Al3+、NO3-、SO42-;Fe3+、Ba2+、HCO3-;
(2)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
④硫酸根离子加入氯化钡生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;Ba2++SO42-=BaSO4↓;
(3)检验某未知溶液中是否含有SO42-,应先加盐酸酸化,若有沉淀,则过滤,排除其它离子的干扰,再加氯化钡,生成白色沉淀可检验,
故答案为:取待测液,先加盐酸酸化,取上层清液,滴加氯化钡溶液,若产生白色沉淀,说明原溶液含有SO42-.
点评 本题考查离子的推断,为高频考点,把握离子的颜色、离子之间的反应为解答的关键,侧重分析、推断能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 最外层有两个电子的原子都是金属原子 | |
| B. | 最外层有五个电子的原子都是非金属原子 | |
| C. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子 | |
| D. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24% | B. | 30% | C. | 40% | D. | 19% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
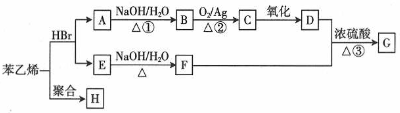
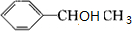 ;H的结构简式
;H的结构简式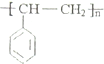 .
.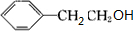 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2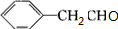 +2H2O ③
+2H2O ③ +
+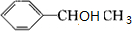 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$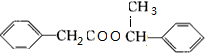 +H2O
+H2O .(任写一种)
.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
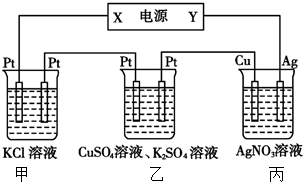
| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:导管口气体可被点燃,产生淡蓝色火焰 | |
| B. | 实验Ⅱ:振荡后静置,溶液分层,且两层均接近无色 | |
| C. | 实验Ⅲ:试管中有气泡冒出,溶液颜色无明显变化 | |
| D. | 实验Ⅳ:试管内气体颜色逐渐变浅,试管壁出现油状液滴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 浓硫酸不与铁、铝发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,溶液中H+向PbO2电极迁移 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g | |
| C. | 充电时,电解质溶液的pH增大 | |
| D. | 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com