
【题目】实验室用50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 23.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 _________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是 ______ .大烧杯如不盖硬纸板,求得的中和热数值将 ______ (填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在 ______ 中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= ________
[盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容(c)按4.18J(g℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 ______ (填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”或“不相等”),所求中和热 ______ (填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 __________ .
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
【答案】铜丝是热的良导体,传热快,热量损失大提高装置的保温效果偏小保温瓶(保温杯)-56.8 kJ/mol偏大不相等相等ABDF
【解析】
(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,故答案为:Cu传热快,热量损失大;
(2)在中和反应中,必须确保热量不散失,应提高装置的保温效果;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;故答案为:提高装置的保温效果;偏小;保温杯;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.35℃;三次温度差的平均值为3.40℃,50mL0.50molL-1盐酸、50mL0.55molL-1NaOH溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.40℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL0.55molL-1的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关,测得中和热数值相等,故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;C、做本实验的室温和反应热的数据之间无关,故C错误;D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱完全反应,导致实验测得中和热的数值偏高,故E错误;F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;故选:ABDF。


科目:高中化学 来源: 题型:
【题目】1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔B.丙炔C.丁炔D.1,3﹣丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应
A. ②③ B. ②④ C. ①② D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银的冶炼有很多方法, 在《 天工开物》 均有记载, 而现代流行的“ 氰化法”, 用 NaCN溶液浸出矿石中的银的方法是最常用的方法。 该方法具备诸多优点: 银的回收率高; 对游离态和化合态的银均能浸出; 对能源消耗相对较少; 生产工艺简便等, 但氰化物通常有毒。 其炼制工艺简介如下:

(1)矿石需要先进行破碎、 研磨, 其目的是__________。
(2)写出该工艺的一个明显的缺点__________ 。
(3)用 NaCN 浸泡矿石( 该矿石是辉银矿, 其主要成分是 Ag2S) 时, 反应容器处于开口状态, 产生的银以[Ag(CN)2]- 形式存在, 硫元素被氧化至最高价, 试写出主要反应的离子方程式__________。
(4)银往往和锌、 铜、 金等矿伴生, 故氰化法得到的银中往往因含有上述金属而不纯净, 需要进一步纯化, 从而获得纯净的银。 其中方法之一就是进行电解精炼, 在精炼过程中, 含有杂质的银作__________极( 填“阴” 或“阳”), 该电极上发生的主要反应式为__________, 金以__________形式存在。
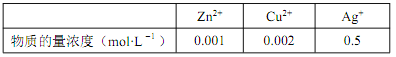
(5)有人提出了另外的提纯银的方案, 先将锌粉还原后的混合金属用略过量的硝酸溶解, 通过精确调整溶液的 pH 来进行金属元素分离, 已知:
①溶解后的离子浓度如下表:
②某些金属离子的氢氧化物 Ksp如下:
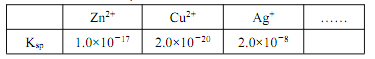
( 已知 lg2=0.3),该设计方案_______(填“ 可行” 或“ 不可行”),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的有关说法中正确的是
A. Fe3O4为红棕色晶体
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D. Fe3+与KSCN试剂产生红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2(g)+SO2(g)![]() NO(g)+ SO3(g),平衡时,下列叙述正确的是
NO(g)+ SO3(g),平衡时,下列叙述正确的是
①NO和SO3的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3的物质的量一定相等
A. ①和②B. ②和③C. ①和③D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
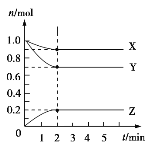
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中.加入少量酸性高锰酸钾溶液.振荡后褪色.正确的解释是( )
A.苯的同系物分子中.碳原子数比苯多
B.苯环受侧链影响.易被氧化
C.侧链受苯环影响.易被氧化
D.由于侧链与苯环的相互影响.使侧链和苯环均易被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com