
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
实验步骤 | 预期现象和结论 |
①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 |
|
② ③
| 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
【思考与交流】(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,则上述实验中步骤②和③的预期现象分别是什么? 。
(1)2 Fe3++2 I-=2 Fe2++I2;(2)1﹕3;
(3)
实验步骤 | 预期现象和结论 |
|
|
②向试管A中加入1 ~ 2滴0.01 mol?L-1的KSCN溶液(2分) ③向试管B中加入1 ~ 2滴0.01 mol?L-1的 KMnO4酸性溶液(2分) |
|
(4)步骤②中溶液变红色,步骤③中溶液不显紫色。
【解析】
试题分析:(1)FeCl3溶液与KI溶液反应的离子方程式为2 Fe3++2 I-=2 Fe2++I2;(2)在该反应中I-作还原剂,化合价由反应前的-1价变为反应后的0价,化合价升高1价,氧化剂是NO3-化合价由反应前的+5价变为反应后NO的+2价,化合价降低。根据氧化还原反应中化合价升降总数相等,可知氧化剂与还原剂的物质的量的比是1﹕3;(3)②向试管A中加入1 ~ 2滴0.01 mol?L-1的KSCN溶液,若溶液不变红色,则假设1成立,否则假设1不成立;③向试管B中加入1 ~ 2滴0.01 mol?L-1的KMnO4酸性溶液,若溶液显紫色,则假设2成立,否则假设2不成立;(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,则上述实验中步骤②预期现象是溶液变红色;③的预期现象是溶液不显紫色。
考点:考查Fe(NO3)3溶液中滴加淀粉KI溶液反应原理的知识。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
下列有机物名称正确的是
A.2-乙基戊烷 B.1,2-二氯丁烷
C.2,2-二甲基-4-己醇 D.3,4-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:选择题
常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-)
B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)
C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L
D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
放射性同位素钬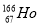 的原子核内的中子数与核外电子数之差是( )
的原子核内的中子数与核外电子数之差是( )
A.32 B.67 C.99 D.166
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
下列酸在与金属发生反应时,其中硫或氮元素的化合价不会发生变化的是( )
A.稀硫酸 B.稀硝酸 C.浓硫酸 D.浓硝酸
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
镁―过氧化氢燃料电池具有能量高、安全方便等优点,其结构示意图如图所示。

下列有关该电池的叙述中正确的是( )
A.该电池可以在高温下正常工作
B.电池工作时,正极周围溶液的PH将不断减少
C.电池工作时,H+向负极移动
D.该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S。下列有关说法正确的是( )
A.OCS、CO2、CO、S晶体类型相同
B.OCS高温分解时,碳元素化合价升高
C.OCS中含有1个σ键和1个π键
D.22.4 L OCS中约含有3×6.02× 1023个原子
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
某烃的结构简式为CH3CH(CH3)CH=C(C2H5)C≡CH,有关其分子结构的叙述正确的是
A.分子中在同一直线上的碳原子数为4 B.分子中在同一直线上的碳原子数为5
C.分子中一定在同一平面上的碳原子数为6 D.分子中在同一平面上的碳原子数最多为7
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:填空题
(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
元素 | 相关信息 |
X | 基态原子最外层电子排布为nsnnpn+1 |
Y | 其原子L层电子数是K层3倍 |
Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
T | 其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。
(4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。
(5)已知25℃、101 kPa下:
①2Z(s)+ 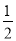 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com