

| A. | 配制950ml 2.3mol/LH2SO4溶液需要取该硫酸125.0mL | |
| B. | 1molAl与足量该硫酸反应产生3g氢气 | |
| C. | 该硫酸在空气中露置,溶质的质量分数会逐渐减小 | |
| D. | 该硫酸不能用来干燥二氧化硫 |
分析 A.浓硫酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制950ml 2.3mol/LH2SO4溶液需要配置1000mL溶液,所以需要取该硫酸体积=$\frac{2.3mol/L×1L}{18.4mol/L}$;
B.常温下浓硫酸和铝发生钝化现象;
C.浓硫酸具有吸水性;
D.浓硫酸具有强氧化性,但不能氧化二氧化硫.
解答 解:A.浓硫酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制950ml 2.3mol/LH2SO4溶液需要配置1000mL溶液,所以需要取该硫酸体积=$\frac{2.3mol/L×1L}{18.4mol/L}$=125mL,故A正确;
B.常温下浓硫酸和铝发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,且反应时生成二氧化硫而不是氢气,故B错误;
C.浓硫酸具有吸水性,所以浓硫酸在空气中露置会吸收空气中水蒸气而导致浓度降低,故C正确;
D.浓硫酸具有强氧化性,二氧化硫具有还原性,但+4价、+6价S元素之间没有化合价,所以不能氧化二氧化硫,故D错误;
故选AC.
点评 本题考查浓硫酸的性质、计算,为高频考点,明确浓硫酸的性质是解本题关键,知道浓硫酸具有强氧化性、吸水性、脱水性,易错选项是D.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 配合物中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | Cl-和NH3分子均参与配位 | |
| D. | Cl-没有孤对电子,NH3有孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 碳酸钙高温下分解 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向右移动 | B. | x+y>z | C. | B的转化率提高 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刺激性气味的气体是氨气 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 | |
| D. | 反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铝可以用做耐火材料 | |
| B. | 铝热反应能放出大量的热,常用于焊接钢轨等 | |
| C. | 铝合金具有密度大、强度高且有一定的抗腐蚀能力,可用于制造能承受强磨损的构件 | |
| D. | 铜被誉为“21世纪的金属”,其应用前景更为广阔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
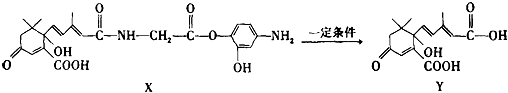
| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com