
”¾ĢāÄæ”æijĶ¬Ń§Éč¼ĘĮĖŅ»øö¼ņµ„µÄŹµŃé£ØČēĶ¼ĖłŹ¾£©£¬ŅŌ²ā¶ØĆ¾ĀĮŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹż”£æɹ©Ń”ÓƵďŌ¼ĮÓŠ£ŗÅØH2SO4”¢ÅØĻõĖį”¢6 mol”¤l-1NaOHČÜŅŗ”£
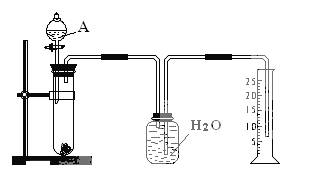
ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
£Ø1£©ÓŠ¹ŲŹµŃé²Ł×÷£ŗa”¢ĶłŹŌ¹ÜÖŠ·ÅČėŹŹĮæµÄĀĮŗĻ½šŃłĘ·£»b”¢“Ó·ÖŅŗĀ©¶·ĶłŹŌ¹ÜÖŠ¼ÓČė¹żĮæµÄAČÜŅŗ£»c”¢¼ģ²é×°ÖƵÄĘųĆÜŠŌ£»d”¢²ā¶ØŹÕ¼Æµ½µÄĖ®µÄĢå»ż”£
ÕżČ·µÄ²Ł×÷Ė³ŠņĪŖ_________________________________________”£
£Ø2£©AČÜŅŗæÉŃ”ÓĆ________________________________________
£Ø3£©ČōŹµŃéÖŠ²āµĆѳʷµÄÖŹĮæĪŖW g £¬ĒāĘųµÄĢå»żĪŖa L£Ø±ź×¼×“æö£©£¬Ōņѳʷ֊AlµÄÖŹĮæ·ÖŹżĪŖ_______________________________________”£
”¾“š°ø”æcabd 6mol”¤l-1NaOHČÜŅŗ 9a/11.2w”Į100%
”¾½āĪö”æ
ÓĆÅÅĖ®·ØŹÕ¼ÆĘųĢå,ŹµŃéŹĒĶعż²ā¶ØÉś³ÉĒāĘųµÄĢå»ż,øł¾Ż¼ĘĖćČ·¶ØŗĻ½šÖŠAlµÄÖŹĮæ·ÖŹż,
(1)ŹÕ¼ÆĘųĢåµÄĢå»ż,¼ÓČėŅ©Ę·Ē°ĻČ¼ģŃé×°ÖƵÄĘųĆÜŠŌ,Č»ŗó¼ÓČČ½šŹōŗĻ½š,ŌŁ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ,²ā¶ØŹÕ¼Æµ½µÄĖ®µÄĢå»żČ·¶ØÉś³ÉĒāĘųµÄĢå»ż£»
(2)ÓĆÅÅĖ®·ØŹÕ¼ÆĘųĢå,ŹµŃéŹĒĶعż²ā¶ØÉś³ÉĒāĘųµÄĢå»ż£»
(3)øł¾ŻÉś³ÉĒāĘųµÄĢå»ż¼ĘĖćŗĻ½šÖŠAlµÄÖŹĮæ,½ų¶ų¼ĘĖćŗĻ½šÖŠAlµÄÖŹĮæ·ÖŹż”£
ÓĆÅÅĖ®·ØŹÕ¼ÆĘųĢå,ŹµŃéŹĒĶعż²ā¶ØÉś³ÉĒāĘųµÄĢå»ż,øł¾Ż¼ĘĖćČ·¶ØŗĻ½šÖŠAlµÄÖŹĮæ·ÖŹż,
(1)ŹÕ¼ÆĘųĢåµÄĢå»ż,¼ÓČėŅ©Ę·Ē°ĻČ¼ģŃé×°ÖƵÄĘųĆÜŠŌ,Č»ŗó¼ÓČČ½šŹōŗĻ½š,ŌŁ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ,²ā¶ØŹÕ¼Æµ½µÄĖ®µÄĢå»żČ·¶ØÉś³ÉĒāĘųµÄĢå»ż,¹ŹÕżČ·µÄ²Ł×÷Ė³ŠņĪŖcabd,
“š°øŹĒ:cabd£»
(2)ÓĆÅÅĖ®·ØŹÕ¼ÆĘųĢå,ŹµŃéŹĒĶعż²ā¶ØÉś³ÉĒāĘųµÄĢå»ż,¹ŹAÖŠŹŌ¼ĮĪŖ6mol”¤l-1NaOHČÜŅŗ£»
“š°øŹĒ: 6mol”¤l-1NaOHČÜŅŗ£»
(3)ŹµŃéÖŠ²āµĆѳʷµÄÖŹĮæĪŖWg,ĒāĘųµÄĢå»żĪŖaL(±ź×¼×“æö),Ōņ:
2Al+2NaOH+2H2OØT2NaAlO2+3H2”ü
54g 3”Į22.4
m(Al) aL
ĖłŅŌm(Al)=54”Įa/3”Į22.4=18a/22.4g£»¹ŹŗĻ½šÖŠAlµÄÖŹĮæ·ÖŹż=18a/22.4w”Į100%=9a/11.2w”Į100%£»
“š°øŹĒ: 9a/11.2w”Į100%”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§×é×°ĮĖČēĶ¼ĖłŹ¾µÄµē»ÆѧװÖĆ£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A.Ķ¼ÖŠ¼×³ŲĪŖŌµē³Ų×°ÖĆ£¬Cuµē¼«·¢Éś»¹Ō·“Ó¦
B.ŹµŃé¹ż³ĢÖŠ£¬¼×³Ų×ó²ąÉÕ±ÖŠNO3-µÄÅØ¶Č²»±ä
C.Čō¼×³ŲÖŠAgµē¼«ÖŹĮæŌö¼Ó5.4gŹ±£¬ŅŅ³Ųijµē¼«Īö³ö1.6g½šŹō£¬ŌņŅŅÖŠµÄijŃĪČÜŅŗæÉÄÜŹĒAgNO3ČÜŅŗ
D.ČōÓĆĶÖĘUŠĪĪļ“śĢę”°ŃĪĒÅ”±£¬¹¤×÷Ņ»¶ĪŹ±¼äŗóČ”³öUŠĶĪļ³ĘĮæ£¬ÖŹĮæ²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖę×ŲÄĮĻæĘѧµÄ·¢Õ¹£¬½šŹō·°¼°Ęä»ÆŗĻĪļµĆµ½ĮĖŌ½Ą“Ō½¹ć·ŗµÄÓ¦ÓĆ£¬²¢±»ÓžĪŖ”°ŗĻ½šµÄĪ¬ÉśĖŲ”±”£ĪŖ»ŲŹÕĄūÓĆŗ¬·°“߻ƼĮ£Øŗ¬ÓŠV2O5”¢VOSO4¼°²»ČÜŠŌ²ŠŌü£©£¬æĘŃŠČĖŌ±×īŠĀŃŠÖĘĮĖŅ»ÖÖĄė×Ó½»»»·Ø»ŲŹÕ·°µÄŠĀ¹¤ŅÕ£¬»ŲŹÕĀŹ“ļ91.7%ŅŌÉĻ”£²æ·Öŗ¬·°ĪļÖŹŌŚĖ®ÖŠµÄČܽāŠŌČēĻĀ±ķĖłŹ¾£ŗ
ĪļÖŹ | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
ČܽāŠŌ | æÉČÜ | ÄŃČÜ | ÄŃČÜ | Ņ×ČÜ |
øĆ¹¤ŅÕµÄÖ÷ŅŖĮ÷³ĢČēĻĀ”£

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¾¹żČČÖŲ·ÖĪö²āµĆ£ŗNH4VO3ŌŚ±ŗÉÕ¹ż³ĢÖŠ£¬¹ĢĢåÖŹĮæµÄ¼õÉŁÖµ£Øׯ×ų±ź£©ĖęĪĀ¶Č±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾”£ŌņNH4VO3ŌŚ·Ö½ā¹ż³ĢÖŠ_________”£

A£®ĻČ·Ö½āŹ§Č„H2O£¬ŌŁ·Ö½āŹ§Č„NH3 B£®ĻČ·Ö½āŹ§Č„NH3£¬ŌŁ·Ö½āŹ§Č„H2O
C£®Ķ¬Ź±·Ö½āŹ§Č„H2OŗĶNH3 D£®Ķ¬Ź±·Ö½āŹ§Č„H2”¢N2ŗĶH2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÖʱø±ūĻ©µÄ·½·ØÓŠ¶ąÖÖ£¬¾ßĢåČēĻĀ£Ø±¾Ģā±ūĻ©ÓĆC3H6±ķŹ¾£©£ŗ
ŅŃÖŖt1minŹ±“ļµ½Ę½ŗāדĢ¬£¬²āµĆ“ĖŹ±ČŻĘ÷ÖŠn(C4H8)=mmol£¬n(C2H4)=2mmol£¬n(C3H6)=nmol£¬ĒŅĘ½ŗāŹ±C3H6µÄĢå»ż·ÖŹżĪŖ![]() ”£
ӣ
¢ŁøĆŹ±¼ä¶ĪÄŚµÄ·“Ó¦ĖŁĀŹv(C4H8)= _______mol/(L”¤min)”££ØÓĆÖ»ŗ¬m”¢V”¢t1µÄŹ½×Ó±ķŹ¾£©”£
¢Ś“Ė·“Ó¦µÄĘ½ŗā³£ŹżK=______________”£
¢Ūt1minŹ±ŌŁĶłČŻĘ÷ÄŚĶØČėµČĪļÖŹµÄĮæµÄC4H8ŗĶC2H4£¬ŌŚŠĀĘ½ŗāÖŠC3H6µÄĢå»ż·ÖŹż_______![]() (Ģī”°>”±”°<”±”°=”±)”£
(Ģī”°>”±”°<”±”°=”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Į׏ĒµŲæĒÖŠŗ¬Įæ½ĻĪŖ·įø»µÄ·Ē½šŹōŌŖĖŲ£¬Ö÷ŅŖŅŌÄŃČÜÓŚĖ®µÄĮ×ĖįŃĪČēCa3£ØPO4£©2µČŠĪŹ½“ęŌŚ”£ĖüµÄµ„ÖŹŗĶ»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²śÖŠÓŠ×ÅÖŲŅŖµÄÓ¦ÓĆ”£
°×Į×£ØP4£©æÉÓÉCa3£ØPO4£©2”¢½¹ĢæŗĶSiO2ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦»ńµĆ”£Ļą¹ŲČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
2Ca3£ØPO4£©2£Øs£©+10C£Øs£©ØT6CaO£Øs£©+P4£Øs£©+10CO£Øg£©”÷H1£½+3359.26 kJmol©1
CaO£Øs£©+SiO2£Øs£©ØTCaSiO3£Øs£©”÷H2£½©89.61 kJmol©1
Š“³ö°×Į×£ØP4£©ÓÉCa3£ØPO4£©2”¢½¹ĢæŗĶSiO2ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ_____”£
£Ø2£©µē×Ó¹¤ŅµÖŠĒåĻ“¹čʬÉĻµÄSiO2£Øs£©µÄ·“Ó¦ĪŖSiO2£Øs£©+4HF£Øg£©ØTSiF4£Øg£©+2H2O£Øg£©”÷H£Ø298.15 K£©£½©94.0 kJmol©1”÷S£Ø298.15 K£©£½©75.8 Jmol©1K©1£¬Éč”÷HŗĶ”÷S²»ĖęĪĀ¶Č¶ų±ä»Æ£¬“Ė·“Ó¦×Ō·¢½ųŠŠµÄĪĀ¶ČŹĒ_____
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ·Ö×ÓŹ½ĪŖC4H8O2µÄÓŠ»śĪļµÄĶ¬·ÖŅģ¹¹ĢåµÄĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ( )
A. ŹōÓŚõ„ĄąµÄÓŠ4ÖÖ
B. ŹōÓŚōČĖįĄąµÄÓŠ2ÖÖ
C. ¼Čŗ¬ÓŠōĒ»łÓÖŗ¬ÓŠČ©»łµÄÓŠ3ÖÖ
D. “ęŌŚ·Ö×ÓÖŠŗ¬ÓŠĮłŌŖ»·µÄĶ¬·ÖŅģ¹¹Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ“ęŌŚČēĻĀ·“Ó¦2SO2(g)£«O2(g) ![]() 2SO3(g) ¦¤H £¼0£¬Ä³Ń§Ļ°Š”×éŃŠ¾æĮĖĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶ŌÉĻŹö·“Ó¦µÄÓ°Ļģ£¬ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ ( )
2SO3(g) ¦¤H £¼0£¬Ä³Ń§Ļ°Š”×éŃŠ¾æĮĖĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶ŌÉĻŹö·“Ó¦µÄÓ°Ļģ£¬ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ ( )
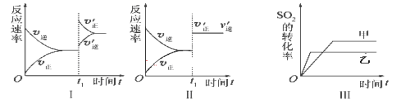
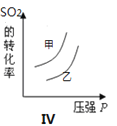
A.Ķ¼¢ń±ķŹ¾µÄŹĒt1Ź±æĢŌö“óO2µÄÅØ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
B.Ķ¼¢ņ±ķŹ¾µÄŹĒt1Ź±æĢ¼ÓČė“߻ƼĮŗó¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
C.Ķ¼¢ó±ķŹ¾µÄŹĒŃ¹Ēæ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬ĒŅŅŅµÄŃ¹Ēæ½Ļøß
D.Ķ¼IV±ķŹ¾µÄŹĒĪĀ¶Č”¢Ń¹Ēæ¶ŌĘ½ŗāµÄÓ°Ļģ£¬ĒŅ¼×µÄĪĀ¶Č±ČŅŅµÄøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ź×¼×“æöĻĀ£¬Ļņ2mol”¤L-1µÄNaOHČÜŅŗ100mLÖŠ»ŗ»ŗĶØČė4.48LCO2ĘųĢ壬³ä·Ö·“Ó¦ŗóČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ÅÅĮŠĖ³ŠņÕżČ·µÄŹĒ
A.c(Na+)£¾c(![]() )£¾c(OH£)£¾c(H+)B.c(Na+)+ c(H+)=c(
)£¾c(OH£)£¾c(H+)B.c(Na+)+ c(H+)=c(![]() )+ c(OH£)
)+ c(OH£)
C.c(Na+)£¾c(![]() )£¾c(H+)£¾c(OH£)D.c(Na+)=c(
)£¾c(H+)£¾c(OH£)D.c(Na+)=c(![]() )£¾c(OH£)£¾c(H+)
)£¾c(OH£)£¾c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬½«2 mol AŗĶ1 mol B·ÅČėŅ»ĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗA(g)£«B(g)![]() 2C(s)£«2D(g)£¬5 minŗó·“Ó¦“ļµ½Ę½ŗā£¬²āµĆÉś³ÉCĪŖ0£®8 mol£¬ĻĀĮŠĻą¹Ų±ķŹöÕżČ·µÄŹĒ
2C(s)£«2D(g)£¬5 minŗó·“Ó¦“ļµ½Ę½ŗā£¬²āµĆÉś³ÉCĪŖ0£®8 mol£¬ĻĀĮŠĻą¹Ų±ķŹöÕżČ·µÄŹĒ
A.øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ŹĒK£½![]()
B.øĆĢõ¼žĻĀBµÄĘ½ŗā×Ŗ»ÆĀŹŹĒ40%
C.Ōö“óøĆĢåĻµµÄŃ¹Ē棬AµÄ×Ŗ»ÆĀŹŌö“ó
D.ČōĻņĘ½ŗāĢåĻµÖŠ¼ÓČėÉŁĮæÉś³ÉĪļC£¬ŌņÕż”¢Äę·“Ó¦ĖŁĀŹ¾łŌö“ó
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com