
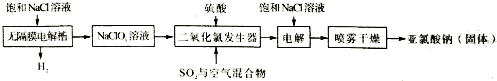
分析 电解法生产亚氯酸钠的工艺流程:无隔膜电解槽电解饱和氯化钠溶液,NaCl+3H2O $\frac{\underline{\;电解\;}}{\;}$ NaClO3+3H2↑,得到氯酸钠溶液,氯酸钠(NaClO3)在酸性条件下被二氧化硫还原成二氧化氯,2NaClO3+SO2=Na2SO4+2ClO2,ClO2在二氧化硫和空气混合气体中不易分解爆炸,通入空气的目的是稀释ClO2,防止ClO2爆炸,将ClO2通入电解槽,阳极发生氧化反应,氯离子放电生成ClO2,生成氢离子,阳极电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,阴极5ClO2+5e-=5ClO2-,喷雾干燥得到亚氯酸钠固体.
(1)在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去,根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq);
(2)无隔膜电解槽内电解饱和氯化钠溶液生成氯酸钠和氢气;
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物,据此书写方程式,纯的ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,需通入空气稀释ClO2;
(4)电解时阴极二氧化氯得到电子生成亚氯酸根离子;
(5)NaClO2变质可分解为NaClO3和NaCl,方程式为3NaClO2=2NaClO3+NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,运用氧化还原反应理论电子转移判断解答;
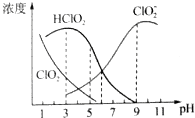
(6)A.由图可以得出:碱性条件下ClO2-浓度高;
B.HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$结合图示数据来计算;
C.根据图知,pH=7时,c(HClO2)<c( ClO2-);
D.根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的pH更适合漂白.
解答 解:(1)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s)而释放出SO42-,
故答案为:BaCl2;BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s)而释放出SO42-(或其它合理答案);
(2)根据流程图可知:无隔膜电解槽电解饱和氯化钠溶液,反应物为氯化钠、水,生成物为氯酸钠,根据原子守恒、得失电子守恒可知,该反应为:NaCl+3H2O $\frac{\underline{\;电解\;}}{\;}$ NaClO3+3H2↑,
故答案为:NaCl+3H2O $\frac{\underline{\;电解\;}}{\;}$ NaClO3+3H2↑;
(3)二氧化氯发生器中生成ClO2,用二氧化硫还原NaClO3生成ClO2,一定有NaClO3→ClO2,化合价降低,被还原;则SO2必定被氧化,有硫酸根离子产生,反应的方程式为:2NaClO3+SO2=Na2SO4+2ClO2,ClO2在二氧化硫和空气混合气体中不易分解爆炸,通入空气的目的是稀释ClO2,防止ClO2爆炸,
故答案为:2NaClO3+SO2=Na2SO4+2ClO2;稀释ClO2,防止ClO2爆炸;
(4)将ClO2通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,电解,阳极发生氧化反应,氯离子放电生成ClO2,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,阴极二氧化氯得到电子,电极反应式为:5ClO2+5e-=5ClO2-,即ClO2+e-=ClO2-,
故答案为:ClO2+e-=ClO2-;
(5)NaClO2变质可分解为NaClO3和NaCl,Cl元素从+3价变为+5价和-1价,反应为3NaClO2=2NaClO3+NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,最终得到Cl元素由+3价变为-1价,所以NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同,所以两份试样消耗FeSO4的物质的量相同,
故答案为:相同;
(6)A.由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A正确;
B.当pH=6时,c(ClO-)=c(HClO),HClO2的电离平衡常数K=$\frac{c({H}^{+})c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=10-6,故B正确;
C.根据图知,pH=7时,存在c(HClO2)<c( ClO2-),则离子浓度大小顺序是c( ClO2-)>c(HClO2)>c( ClO2)>c( Cl-),故C错误;
D.根据题意:HClO2和ClO2都具有漂白作用,则图中HClO2和ClO2的浓度之和最大时漂白效果最好,所以该漂白剂的最佳pH在1-3,HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图象知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,所以25℃时,该溶液在pH=4时比pH=11时更适合漂白,故D正确;
故答案为:ABD.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以电解法法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力的理解、对电解相关知识的运用、有关实验操作以及在新情境下综合运用知识解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | K+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
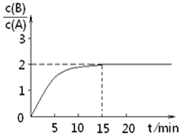 某温度下在2L密闭容器中加人一定量A,发生以下化学反应:
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为4mol | |
| C. | 反应到达平衡时,放出的热量是193kJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
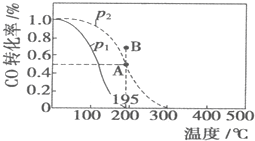 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
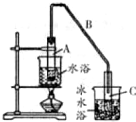 某化学小组以环己醇
某化学小组以环己醇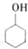 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com