
 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)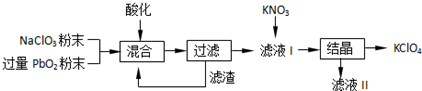
分析 (1)根据铅蓄电池的特点可知,铅蓄电池电压稳定、使用方便、安全可靠、价格低廉,依据电池反应,放电过程是原电池反应,Pb电极做负极,发生氧化反应;充电过程是电解池,PbO2电极做电解池阳极;
(2)工业用PbO2来制备KClO4,是在酸性条件下用PbO2将NaClO3氧化成NaClO4,过滤得含有NaClO4的溶液中加入硝酸钾,经结晶可得KClO晶体,
①根据溶液中溶解度小的物质先析出,结合复分解反应的条件可判断溶解度较小的物质;
②NaClO3与PbO2反应,+4价的铅能将氯酸根氧化成高氯酸根,根据电荷守恒和元素守恒书写离子方程式;
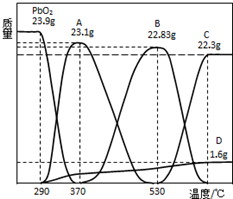
(3)依据图象分析,可计算出A点和B点中铅和氧的物质的量之比,进而确定两个点的物质组成,剩余固体的质量为22.94g时,介于AB之间,据此判断;
(4)根据(3)中的计算,运用元素守恒可计算出各物质的物质的量之比.
解答 解:(1)根据铅蓄电池的特点可知,铅蓄电池的优点是电压稳定、使用方便、安全可靠、价格低廉等,放电过程是原电池反应,Pb电极做负极,发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,生成的硫酸铅附着在铅电极上,所以其质量增加,充电过程是电解池,PbO2电极做电解池阳极,所以要与电源的正极相连,电极反应式为 PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq),
故答案为:电压稳定、使用方便、安全可靠、价格低廉等;增大;正极; PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq);
(2)①根据题中流程可知,KNO3和NaClO4反应能生成KClO4和NaNO3,结晶后得到KClO4,可推知KClO4的溶解度较小,
故答案为:KClO4;
②依据流程分析,二氧化铅是氧化剂把氯酸钾氧化为高氯酸钾,铅元素化合价降低为二价,反应在酸性溶液中进行,反应的离子方程式为:PbO2+ClO3-+2H+=Pb2++ClO4-+H2O,
故答案为:PbO2+ClO3-+2H+=Pb2++ClO4-+H2O;
(3)23.9gPbO2物质的量=$\frac{23.9g}{239g/mol}$=0.1mol,其中氧原子为0.2mol,图象中A点固体质量减少=23.9g-23,1g=0.8g,减少的是氧元素质量为0.05mol,所以剩余氧原子物质的量=0.2mol-0.05mol=0.15mol,剩余铅和氧原子物质的量之比=0.1mol:0.15mol=2:3,对应A点位置为Pb2O3;B点固体减少=23.9g-22.83g=1.07g,减少的氧原子物质的量=$\frac{1.07g}{16g/mol}$=0.07mol,剩余氧原子物质的量=0.2mol-0.07mol=0.13mol,反应剩余铅和氧原子物质的量之比=0.1mol:0.13mol≈3:4,剩余固体22.94g,介于AB之间,所以固体是Pb2O3和Pb3O4 的混合物,
故答案为:Pb2O3和Pb3O4;
(4)由(3)的计算可知,固体是Pb2O3和Pb3O4 的混合物,设Pb2O3物质的量为x,Pb3O4 物质的量为y,
得到2x+3y=0.1、3x+4y=0.2-$\frac{23.9-22.94}{16}$=0.14,
解得:x=y=0.02,
物质的量之比为1:1;
故答案为:1:1.
点评 本题以PbO2为情景设计考查原电池原理的应用,反应流程分析判断,有关图象分析和元素守恒的计算是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com