
【题目】关于乙烯和乙烷的说法中,不正确的是
A.乙烯属于不饱和烃,乙烷属于饱和烃
B.乙烯中所有原子处于同一平面,乙烷中原子不在同一平面
C.乙烯分子中的碳碳双键比乙烷中碳碳单键更稳定,不易发生化学反应
D.都可以使酸性高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】能在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42﹣、OH﹣、K+
B.Fe3+、NO3﹣、Cl﹣、H+
C.K+、CO32﹣、Cl﹣、H+
D.H+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸)或c(H+) | c(NaOH)/mol/L | 混合溶液的pH |
甲 | c(H+)=0.1 mol/L的HX酸 | 0.1 | pH=a |
乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
丙 | c(HZ)=0.1 mol/L | 0.1 | pH=9 |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY溶液的pH=______。
(3)丙组实验发生反应的离子方程式为__________________,
所得溶液中由水电离出的c(OH-)=______mol/L。
II. 将0.1 mol·L-1 NaOH溶液分别滴入体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图:
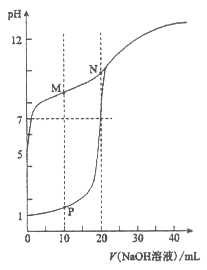
(1)HA为_______酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用离子方程式表示)_________。
(3)下列说法正确的是_______ (填字母)。
a. M点c(HA)-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
(4)NaA与NaOH等浓度等体积混合时,溶液中c(A-)______c(OH-)(填“<”,“=”或“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水。浓海水中主要含有的离子有Na+、 Mg2+ 、Cl﹣、SO42﹣。从浓海水中提取金属镁的一段工艺流程如图所示:
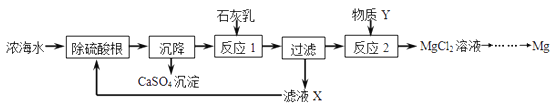
(1)写出反应2的化学方程式:_________________________________________。
(2)操作流程中可循环使用的物质是___________(填化学式)。
(3)在实验室如何证明溶液中的SO42﹣已完全沉淀:_____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是

A. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
B. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- )
C. 25℃时,碳酸的第一步电离常数Ka1=10-7
D. 溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐是一类常见的物质,下列物质可直接反应生成盐的是( )
①金属 ②非金属 ③酸 ④碱 ⑤酸性氧化物 ⑥碱性氧化物.
A.只有③④
B.只有①②
C.只有①③⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A.原电池放电时,电子由负极经电解质溶液流向正极
B.原电池是将电能转变为化学能的装置
C.在原电池中,电流流入的一极是负极,该电极发生氧化反应
D.构成原电池的正极和负极必须是两种不同的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
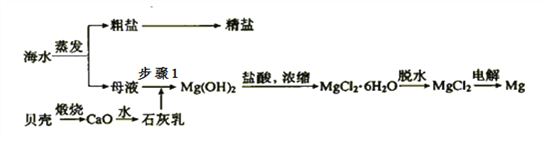
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com