


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶于水后,在电流作用下电离成Na+和Cl- |
| B、在水溶液里,能电离出H+的化合物叫酸 |
| C、碳酸钙难溶于水,但碳酸钙是强电解质 |
| D、氯气溶于水后,能部分电离出H+和Cl-,故氯气属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(H+)=1.0×10-2 mol?L-1 |
| B、pH=12 |
| C、pH=2 |
| D、混合后的溶液溶质的物质的量浓度为0.02 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
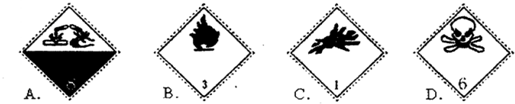
| A、图中所示标志是腐蚀品标志 |
| B、图中所示标志是易燃品标志 |
| C、图中所示标志是爆炸品标志 |
| D、图中所示标志是剧毒品标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐--③④ |
| B、纯净物--④⑤⑥ |
| C、碱--④⑤ |
| D、混合物--②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
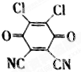 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com