
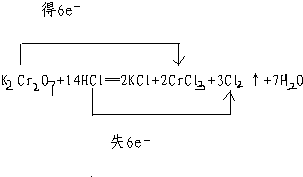
(8分)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物;1mol K2Cr2O7反应时转移电子为 mol.
(最后一空2分,其余每空1分,共8分)
K2Cr2O7 HCl Cl Cr Cl2 CrCl3 6mol
解析试题分析:根据方程式可知,铬元素的化合价从+6价降低到+3价,得到3个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以K2Cr2O7是氧化剂,HCl是还原剂。Cl元素被氧化,Cr被还原。氯气是氧化产物,CrCl3是还原产物。根据化合价的变化可知,1mol K2Cr2O7反应时转移电子为2mol。
考点:考查氧化还原反应的有关判断、计算等
点评:判断氧化还原反应是最关键的是准确判断出有关元素的化合价变化情况,然后根据相应的概念判断即可。而在氧化还原反应的计算中,电子得失守恒是经常用到的关系式。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com