
| A、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| B、由于Fe可被浓H2SO4氧化,因此常温下不能用钢瓶贮浓H2SO4 |
| C、镁铝合金的熔点比镁和铝都高 |
| D、不能用氨水鉴别Al3+﹑Mg2+﹑Ag+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
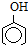 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(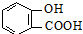 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、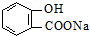 |
| B、NaHCO3 |
C、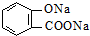 |
| D、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA |
| C、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.2NA |
| D、1 mol Na2O2中含有的阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li、Mg、Al、Sn原子的最外层电子数依次增加,故失去电子的能力越来越强 |
| B、钚(Pu)属于过渡元素,能跟氟形成PuF6,据此可推测Pu原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 |
| D、14C与14N质量数相同,可以互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用丁达尔现象可以鉴别胶体和溶液 |
| B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C、胶体与溶液的分离可用渗析的方法 |
| D、KCl溶液、淀粉溶液和纯水都属于分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g甲基(-14CH3)所含的电子数为10NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3mol NO2和足量H2O反应,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸盐是还原剂 |
| B、维生素C是氧化剂 |
| C、维生素C将Fe3+还原为Fe2+ |
| D、亚硝酸盐被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸与水能以任意比混溶 |
| B、甲酸能与Na2CO3溶液反应,生成CO2气体 |
| C、1mol/L的HCOOH水溶液能使紫色石蕊试液变红 |
| D、1mol/L的HCOONa溶液的pH约为8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大多数有机物难溶于水,易溶于汽油、苯等有机溶剂 |
| B、有机物的熔点低 |
| C、有机物都是非电解质,不易导电 |
| D、有机物的化学反应比较复杂,一般较慢,且常伴有副反应发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com